研究方向
癌症的治疗是我国乃至全球经济社会发展所面临的严峻挑战。相比于传统疗法,近年来兴起的免疫治疗采用了新的策略,并取得了突破性的进展。然而,目前仅有小部分肿瘤患者能够从免疫治疗中获益,且肿瘤针对治疗产生的耐药时有发生。如何改进现有免疫疗法的效果,成为亟待解决的问题。本课题组综合运用小鼠动物模型、抗体工程技术、高通量筛选等方法与手段,聚焦研究肿瘤微环境中的免疫调节机制,以及它们在免疫治疗中的功能与应用。具体研究方向包括:1)筛选与鉴定肿瘤发生与转移过程中的驱动因子,并研发新的免疫治疗策略;2)研究肿瘤微环境中的免疫抑制与免疫激活调控机制,以及它们在免疫治疗中的作用;3)设计与研发新的可用于肿瘤免疫治疗的下一代抗体药物。
科学贡献
我们对肿瘤免疫治疗过程中,肿瘤内浸润的T细胞(TILs)功能做了系统的研究。我们的研究证明,通过促进T细胞浸润、增强树突状细胞所介导的抗原交叉递呈,能够有效地提高治疗的有效性,并有希望打破肿瘤的耐药性。基于这些研究,我们研发了若干种可以有效提高肿瘤内淋巴细胞浸润或T细胞活化的下一代抗体药物,并且证明这些药物能够打破肿瘤对于免疫检查点阻断疗法的耐药性。我们的研究为临床上提高肿瘤免疫治疗的有效性、以及应对肿瘤耐药性提供了新的潜在方案。
主要研究成果
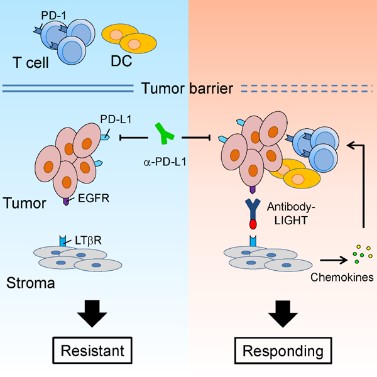
1. 我们对肿瘤免疫治疗过程中,肿瘤浸润T细胞(TILs)的功能进行了系统的研究。我们的工作证明,通过促进T细胞浸润、增强树突状细胞所介导的抗原递呈,能够有效地提高治疗的效率,并有希望克服肿瘤的耐药性。基于这些研究,我们研发了多种可以提高肿瘤内淋巴细胞浸润或T细胞活化的下一代抗体药物,并且证明这些药物能够克服肿瘤对于免疫检查点阻断疗法的耐药性(Cancer Cell, 2016; Nat Commun, 2018)。这些研究为临床上提高肿瘤免疫治疗的有效率、以及应对肿瘤耐药性提供了新的潜在方案。
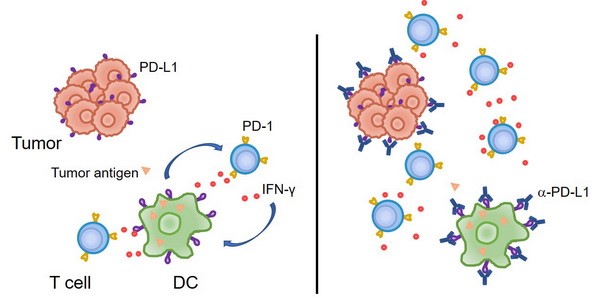
2. 传统的观点认为,肿瘤细胞上表达的PD-L1与T细胞的PD-1相互作用,从而抑制T细胞反应、并导致了肿瘤的免疫逃逸。然而我们的研究发现,至少在某些情况下,髓系细胞、特别是树突状细胞上所表达的PD-L1在免疫治疗中起到了更加关键的作用。肿瘤微环境通过特定机制诱导树突状细胞上调PD-L1,进而抑制了T细胞与抗肿瘤免疫反应(Nat Commun, 2020; J Clin Invest, 2018)。在临床上,肿瘤患者的髓系细胞PD-L1表达水平可以作为生物标志物,更好地预测免疫检查点阻断治疗的预后。
荣誉和奖项
2019年Bayer Investigator Award
2014年Irvington Postdoctoral Fellowship, Cancer Research Institute (New York)
2012年北京生命科学研究院和赛诺菲巴斯德生物医学杰出研究生奖
代表性论文
(#co-first author, *corresponding author)
1. Xiao K#, Zhang S#, Peng Q#, Du Y#, Yao X, Ng I-I, Tang H*. PD-L1 protects tumor-associated dendritic cells from ferroptosis during immunogenic chemotherapy, Cell Rep, 2024, 43: 114868.
2. Ng I-I#, Zhang J#, Tian T#, Peng Q#, Huang Z, Xiao K, Yao X, Ng L*, Zeng J*, Tang H*. Network-based screening identifies sitagliptin as an antitumor drug targeting dendritic cells, J Immunother Cancer, 2024, 12 (3): e008254.
3. Liu C#, Xiao K#, Yu C#, Lei Y#, Lyu K, Tian T, Zhao D*, Zhou F*, Tang H*, Zeng J*. A probabilistic knowledge graph for target identification. PLoS Comput Biol, 2024, 20 (4): e1011945.
4. Peng Q, Qiu X, Zhang Z, Zhang S, Zhang Y, Liang Y, Guo J, Peng H, Chen M, Fu Y-X, Tang H#. PD-L1 on dendritic cells attenuates T cell activation and regulates response to immune checkpoint blockade. Nat Commun. 2020, 11: 4835.
5. Zuo H, Yang D, Yang Q, Tang H, Fu Y-X, Wan Y. Differential regulation of breast cancer bone metastasis by PARP1 and PARP2. Nat Commun. 2020, 11: 1578.
6. Tang H#, Liang Y#, Anders R, Taube J, Qiu X, Mulgaonkar A, Liu X, Harrington S, Guo J, Xin Y, Xiong Y, Nham K, Silvers W, Hao G, Sun X, Chen M, Hannan R, Qiao J, Peng H, Dong H, Fu Y-X. PD-L1 on host cells is essential for tumor regression mediated by PD-L1 blockade. J Clin Invest. 2018, 128: 580-588.
7. Tang H*, Qiu X, Timmerman C, Fu Y-X. Targeting tertiary lymphoid structures for tumor immunotherapy. Methods Mol Biol. 2018, 1845: 275-286.
8. Tang H, Fu Y-X. Immune Evasion in Tumor’s Own Sweet Way. Cell Metab. 2018, 27: 945-946.
9. Liang Y#, Tang H#*, Guo J#, Qiu X, Ren Z, Bian Y, Dong H, Peng H*, Fu Y-X*. Targeting type I interferon into tumor by anti-PD-L1 creates feedforward antitumor responses to overcome innate and adaptive resistance. Nat Commun. 2018, 9: 4586.
10. Lu K, He C, Guo N, Chan C, Ni K, Lan G, Tang H, Pelizzari C, Fu Y-X, Spiotto M, Weichselbaum R, Lin W. Low-dose X-ray radiotherapy-radiodynamic therapy via nanoscale metal-organic frameworks enhances checkpoint blockade immunotherapy. Nat Biomed Eng. 2018, 2: 600-610.
11. Deng M, Gui X, Kim J, Xie L, Chen W, Li Z, He L, Chen Y, Chen H, Luo W, Lu Z, Xie J, Churchill H, Xu Y, Zhou Z, Wu G, Yu C, John S, Hirayasu K, Nguyen N, Liu X, Huang F, Li L, Deng H, Tang H, Sadek AH, Zhang L, Huang T, Zou Y, Chen B, Zhu H, Arase H, Xia N, Jiang Y, Collins R, You MJ, Homsi J, Unni N, Lewis C, Chen GQ, Fu YX, Liao XC, An Z, Zheng J, Zhang N, Zhang CC. LILRB4 signalling in leukaemia cells mediates T cell suppression and tumour infiltration. Nature. 2018, 562: 605-609.
12. Zhang Y, Kim T-J, Wroblewska J, Tesic V, Upadhyay V, Weichselbaum R, Tumornoy A, Tang H, Guo X, Tang H, Fu Y-X. Type 3 innate lymphoid cell-derived lymphotoxin prevents microbiota-dependent inflammation. Cell Mol Immunol. 2017, 14: 1-13.
13. Tang H*, Zhu M, Qiao J, Fu Y-X*. Lymphotoxin signaling in tertiary lymphoid structures and immunotherapy. Cell Mol Immunol. 2017, 14: 809-818.
14. Qiao J, Tang H, Fu Y-X. DNA sensing and immune responses in cancer therapy. Curr Opin Immunol. 2017, 45: 16-20.
15. Wroblewska J, Zhang Y, Tang H, Guo X, Nagler C, Fu Y-X. Cutting Edge: Lymphotoxin Signaling Is Essential for Clearance of Salmonella from the Gut Lumen and Generation of Anti-Salmonella Protective Immunity. J Immunol. 2017, 198: 55-60.
16. Tang H, Wang Y, Chlewicki L, Zhang Y, Guo J, Liang W, Wang J, Wang X, Fu Y-X. Facilitating T cell infiltration in tumor microenvironment overcomes resistance to PD-L1 blockade. Cancer Cell. 2016, 29 (3): 285-296.
17. Tang H, Qiao J, Fu Y-X. Immunotherapy and tumor microenvironment. Cancer Lett. 2016, 370: 85-90.
18. Okwor I, Xu G, Tang H, Liang Y, Fu Y-X, Uzonna J. Deficiency of CD40 reveals an important role for LIGHT in anti-Leishmania immunity. J Immunol. 2015, 195: 194-202.
19. Li C, Yang Z, Du Y, Tang H, Chen J, Hu D, Fan Z. BCMab1, A monoclonal antibody against aberrantly glycosylated integrin a3b1, has potent antitumor activity of bladder cancer in vivo. Clin Cancer Res, 2014, 20: 4001-4013.
20. Tang H, Li C, Wang L, Zhang H, Fan Z. Granzyme H of cytotoxic lymphocytes is required for clearance of the hepatitis B virus through cleavage of the hepatitis B virus X protein. J Immunol.2012, 188: 824-831.
21. Yang Z, Tang H, Huang H, Deng H. RTA promoter demethylation and histone acetylation regulation of murine gamma-herpesvirus 68 reactivation. PLoS One. 2009, 4 (2): e4556.

