研究方向
1.肠道干细胞相关研究:溃疡性结肠炎中肠道干细胞的病变相关研究;研究病理微环境中的细胞因子或微生物代谢产物对肠道干细胞以及肠上皮屏障功能的影响;肠道干细胞衰老研究。
2.肝脏相关研究:肝脏干细胞/胆管细胞在肝纤维化中的病理改变及其对发病机制的影响;肝脏干细胞移植的临床转化研究。
3.肿瘤相关研究:二维肿瘤细胞系和三维肿瘤类器官技术体系的精准医学转化研究;开发、优化预测原发肿瘤转移目的器官的策略;开发优化评估原发肿瘤转移风险的策略。
4.药物吸收模型:胃、肠道气液界面类器官模型在药物吸收模型方面的转化应用。
科学贡献
王霞博士主要从事成体干细胞和人体疾病的研究工作,并取得了突出的研究成果。她们成功利用P63 基因敲除小鼠为模型,揭示了胚胎发育过程中残留在鳞状上皮/柱状上皮交界处的一小部分特异细胞是巴瑞特氏食道肠化生的细胞来源。该机制对深入了解食道腺癌的细胞起源和特异性针对癌症前体的早期诊断及其预防起到了重要作用。此项研究成果发表在国际顶级期刊Cell上。此外,王霞博士创建了一个体外培养肠道成体干细胞以及气液界面类器官的技术平台,利用这一技术,从单个肠上皮干细胞培养出的干细胞系在体外能长期保持良好的自我更新状态和稳定的多向分化潜能,还可以在气液界面培养体系中定向分化成为包含多种细胞类型的三维立体的肠道上皮组织,并首次成功建立了假膜性结肠炎的疾病模型。这项技术是干细胞研究领域的重大突破,为人类成体干细胞及其相关疾病的研究提供了重要的基础研究平台,并在干细胞的临床应用和新型药物开发方面具有重大的应用价值和发展前景。此项研究结果发表在国际顶级期刊Nature上。
此外,王霞博士领导的科研团队创建了高效稳定的二维肿瘤细胞系和三维肿瘤类器官技术平台(Zhao et al., Advanced Science, 2022)。该技术平台体现了二维肿瘤细胞系和三维肿瘤类器官的双重优势,不仅精准地再现了原发性肿瘤的特征,更成功地捕捉到了肿瘤间和肿瘤内药物反应及致瘤性的异质性。该平台可用于构建肿瘤类器官库,作为药物筛选平台,开展肿瘤类器官的临床试验,能够给肿瘤患者提供个性化的药物敏感性预判,并可以促进实现肿瘤个性化和精准医疗。在此技术体系基础上,王霞课题组及其合作团队成功从结直肠癌患者的原发肿瘤组织中建立了单个肿瘤细胞来源的肿瘤细胞系,鉴定了原发肿瘤组织中的转移种子。全面系统地描绘了结直肠癌原发肿瘤组织中转移种子的细胞、分子生物学特征,揭示了其转移目的器官特异性的分子机制。同时,还鉴定了一组可用于预测和评估原发结直肠癌肿瘤转移风险的标志基因(Zhao et al., Journal of Experimental Medicine, 2024)。这项研究不仅为肿瘤转移机制的研究开辟了新的领域,也为未来癌症治疗提供了新的策略和方向。
研究成果
1.2D肠道干细胞和3D气液界面类器官培养体系
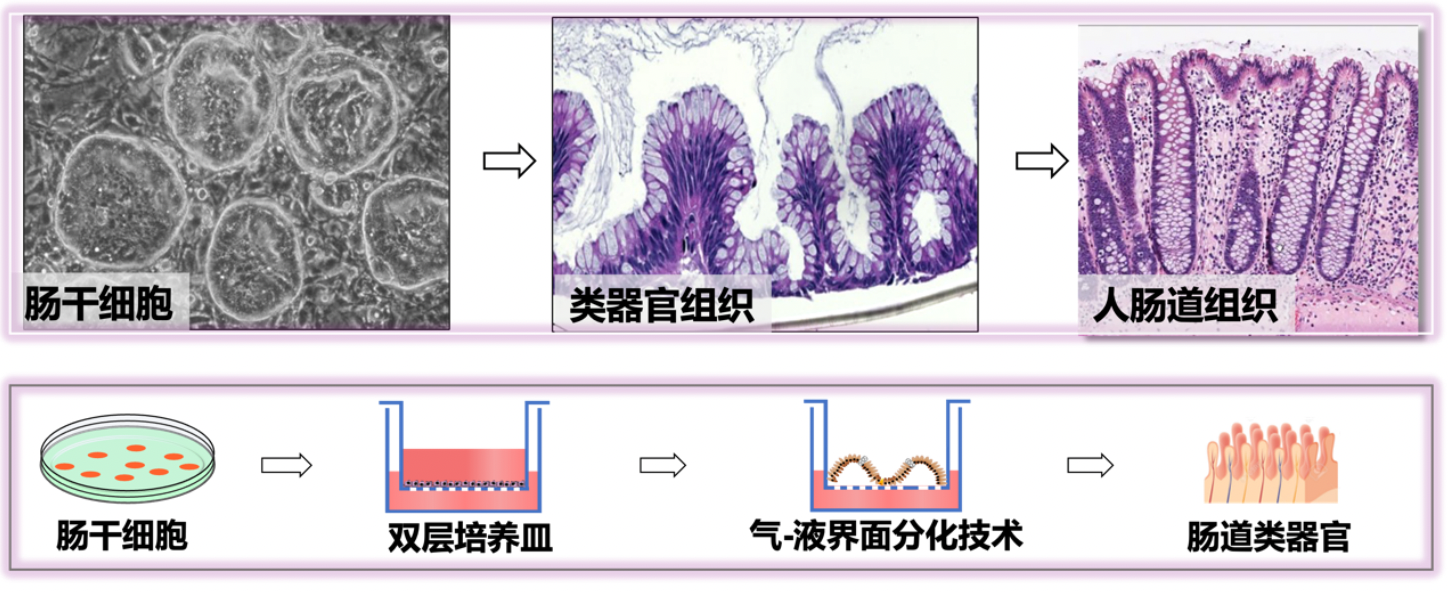
图1:肠道干细胞气液界面类器官技术体系示意图(Wang et al., Nature, 2015)
2.二维肿瘤细胞系和三维肿瘤类器官技术平台
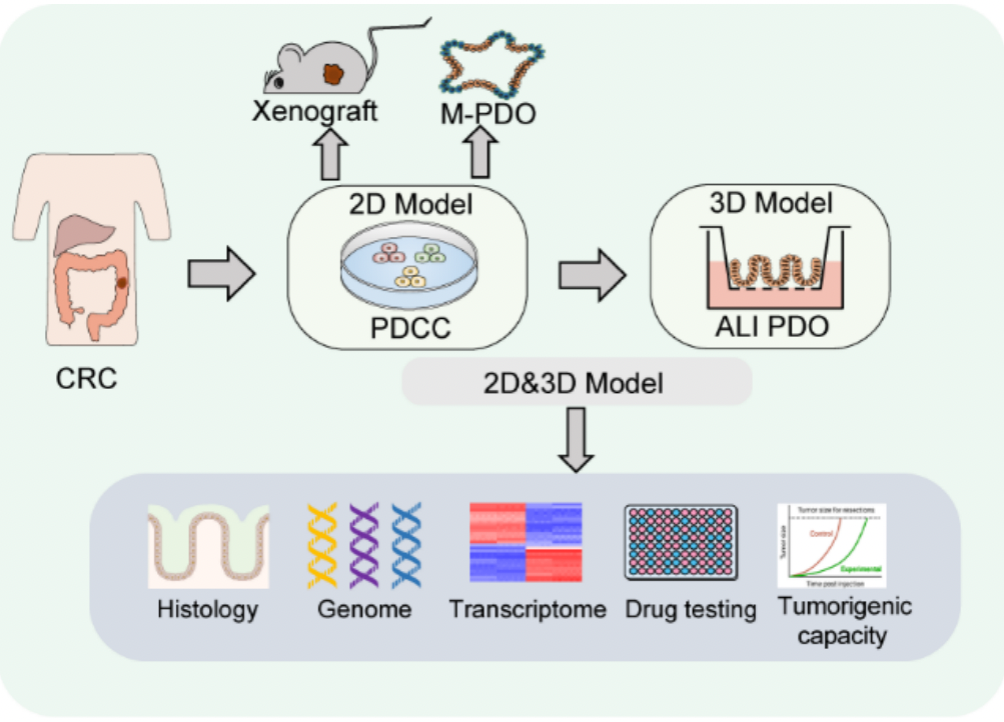
图2:二维肿瘤细胞系和三维肿瘤类器官技术平台示意图(Zhao et al., Advanced Science, 2022)
3.精准医疗的新靶向——原发肿瘤中的转移种子
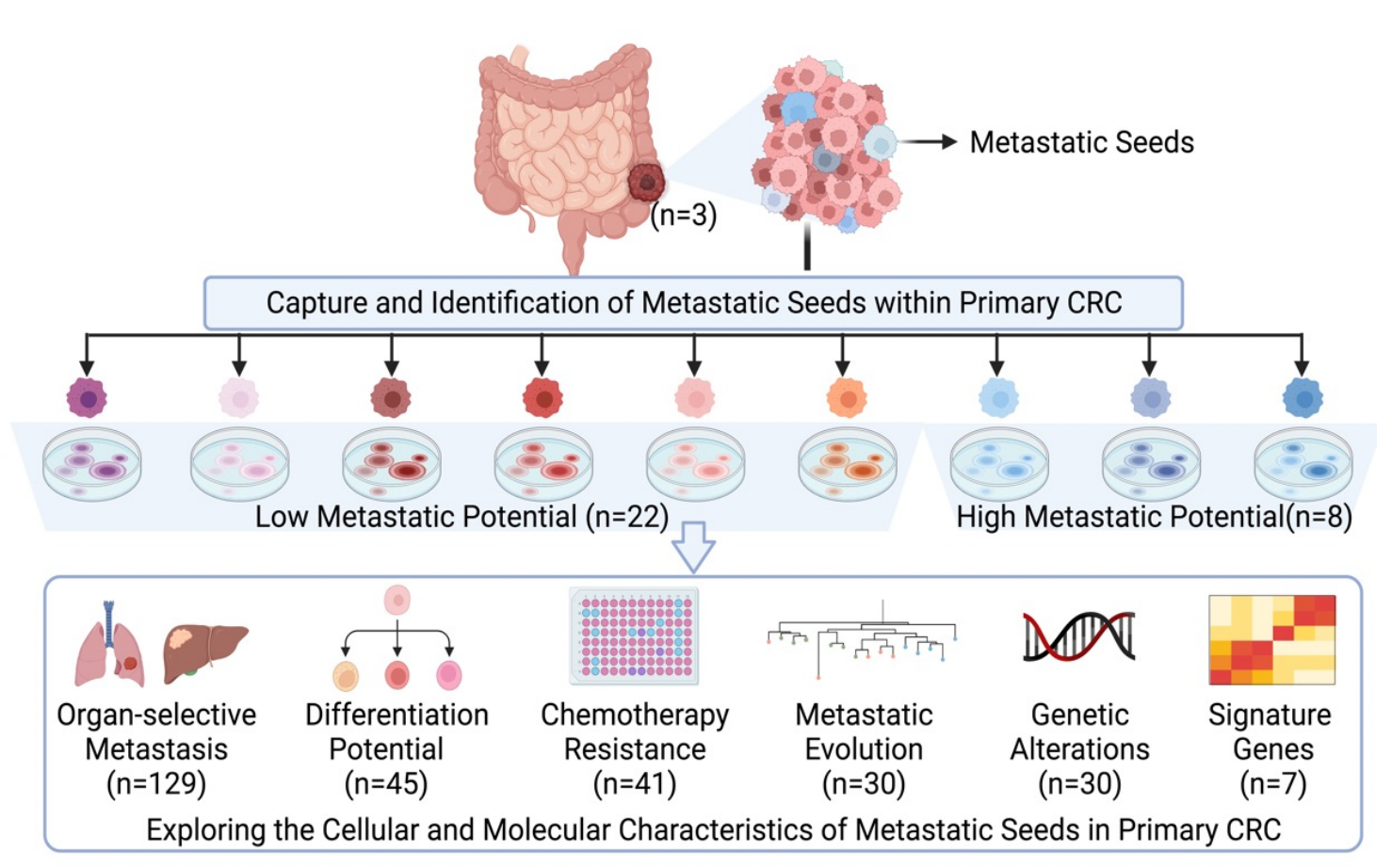
图3. 系统探究结直肠癌原发肿瘤中的转移种子 (Zhao et al., JEM, 2024)
荣誉和奖项
拜耳青年研究员奖,清华大学,2018
拜耳青年研究员奖,清华大学,2017
国家级人才项目青年人才,2016
哈佛华人生命科学年度杰出研究奖,哈佛医学院,2012
优秀论文奖,中科院分子发育生物学重点实验室, 2009
朱李月华优秀博士生奖,中国科学院遗传与发育生物学研究所, 2009
优秀毕业生,中国科学院遗传与发育生物学研究所, 2009
中国科学院研究生奖学金,中国科学院遗传与发育生物学研究所,2005
代表性科研论文:
1. Yuanyuan Zhao#, Bing Zhang#, Yiming Ma#, Mengmeng Guo, Fuqiang Zhao, Jianan Chen, Bingzhi Wang, Hua Jin, Fulai Zhou, Jiawei Guan, Qian Zhao, Qian Liu*, Hongying Wang*, Fangqing Zhao*, Xia Wang*. Distinct molecular profiles drive multifaceted characteristics of colorectal cancer metastatic seeds. Journal of Experimental Medicine (2024 May 6;221(5):e20231359. doi: 10.1084/jem.20231359.)
2. Chuandong Liu#, Jie Li#, Hua Jin#, Qian Zhao#, Fangle Li, Zurui Huang, Boyuan Mei, Wenxuan Gong*, Xia Wang*, Dali Han*. Colonic stem cell from severe ulcerative colitis maintains environment-independent immune activation by altering chromatin accessibility and global m 6A loss. Life Medicine, 2023. 2 (4):1-14.
3. Yuanyuan Zhao#, Mengmeng Guo#, Fuqiang Zhao, Qian Liu and Xia Wang*. Colonic stem cells from normal tissues adjacent to tumor drive inflammation and fibrosis in colorectal cancer. Cell Communication and Signaling, 2023, 21:186.
4. Aging Biomarker Consortium, Hainan Bao#, Jiani Cao#, Mengting Chen#, Min Chen#, Wei Chen#, Xiao Chen#, Yanhao Chen#, Yu Chen#, Yutian Chen#, Zhiyang Chen#, Jagadish K. Chhetri#, Yingjie Ding#, Junlin Feng#, Jun Guo#, Mengmeng Guo#, Chuting He#, Yujuan Jia#, Haiping Jiang#, Ying Jing#, Dingfeng Li#, Jiaming Li#, Jingyi Li#, Qinhao Liang#, Rui Liang#, Feng Liu#, Xiaoqian Liu#, Zuojun Liu#, Oscar Junhong Luo#, Jianwei Lv#, Jingyi Ma#, Kehang Mao#, Jiawei Nie#, Xinhua Qiao#, Xinpei Sun#, Xiaoqiang Tang#, Jianfang Wang#, Qiaoran Wang#, Siyuan Wang#, Xuan Wang#, Yaning Wang#, Yuhan Wang#, Rimo Wu#, Kai Xia#, Fu-Hui Xiao#, Lingyan Xu#, Yingying Xu#, Haoteng Yan#, Liang Yang#, Ruici Yang#, Yuanxin Yang#, Yilin Ying#, Le Zhang#, Weiwei Zhang#, Wenwan Zhang#, Xing Zhang#, Zhuo Zhang#, Min Zhou#, Rui Zhou#, Qingchen Zhu#, Zhengmao Zhu#, Feng Cao*, Zhongwei Cao*, Piu Chan*, Chang Chen*, Guobing Chen*, Hou-Zao Chen*, Jun Chen*, Weimin Ci*, Bi-Sen Ding*, Qiurong Ding*, Feng Gao*, Jing-Dong J. Han*, Kai Huang*, Zhenyu Ju*, Qing-Peng Kong*, Ji Li*, Jian Li*, Xin Li*, Baohua Liu*, Feng Liu*, Lin Liu*, Qiang Liu*, Qiang Liu*, Xingguo Liu*, Yong Liu*, Xianghang Luo*, Shuai Ma*, Xinran Ma*, Zhiyong Mao*, Jing Nie*, Yaojin Peng*, Jing Qu*, Jie Ren*, Ruibao Ren*, Moshi Song*, Zhou Songyang*, Yi Eve Sun*, Yu Sun*, Mei Tian*, Shusen Wang*, Si Wang*, Xia Wang*, Xiaoning Wang*, Yan-Jiang Wang*, Yunfang Wang*, Catherine C. L. Wong*, Andy Peng Xiang*, Yichuan Xiao*, Zhengwei Xie*, Daichao Xu*, Jing Ye*, Rui Yue*, Cuntai Zhang*, Hongbo Zhang*, Liang Zhang*, Weiqi Zhang*, Yong Zhang*, Yun-Wu Zhang*, Zhuohua Zhang*, Tongbiao Zhao*, Yuzheng Zhao*, Dahai Zhu*, Weiguo Zou*, Gang Pei* & Guang-Hui Liu*. Biomarkers of aging. Science China Life Sciences. 2023. 66: 893-1066.
5. Yuanyuan Zhao#, Bing Zhang#, Yiming Ma, Fuqiang Zhao, Jianan Chen, Bingzhi Wang, Hua Jin, Fulai Zhou, Jiawei Guan, Qian Zhao, Hongying Wang, Qian Liu*, Fangqing Zhao*, Xia Wang*. Colorectal cancer patient-derived 2D and 3D models efficiently recapitulate inter- and intra-tumoral heterogeneity. Advanced Science. 2022 (DOI: 10.1002/advs.202201539)
6. Qian Zhao#, Jiawei Guan, Xia Wang*. Intestinal stem cells and intestinal organoids. Journal of Genetics and Genomics. 2020. 47(6):289-299. (Review)
7. Yamamoto Y*, Wang X*(*Co-first authors), Bertrand D, Kern F, Zhang T, Deluba M, Srivastava S, Khor CC, Hu YY, Wilson L, Blaszyk H, Rolshud D, Ming T,Liu JJ, Howitt B, Vincent M, Crum CP, Nagarajan N, Ho KY, McKeon F, and Xian W. Mutational spectrum of Barrett’s stem cells suggests paths to initiation of a precancerous lesion. Nature Communications. 2016. doi: 10.1038/ncomms10380.
8. Wang X*, Yamamoto Y*(*Co-first authors), Wilson LH, Zhang T, Howitt B, Ning G, Hong Y, Khor CC, Chevalier B, Bertrand D, Nagarajan N, Sylvester FA, Farrow MA, Lacy DB, Ho KY, Crum CP, McKeon F and Xian W. Cloning and variation of ground state intestinal stem cells. Nature. 2015. 522(7555):173-178.
9. Wang X*, Ouyang H*, Yamamoto Y*, (*Co-first authors), Kumar PA, Wei TS, Dagher R, Vincent M, Lu X, Bellizzi AM, Ho KY, Crum CP, Xian W, McKeon F. Residual embryonic cells as precursors of a Barrett's-like metaplasia. Cell. 2011. 145(7):1023-35. Featured Article in Cell. Highlighted in Nature Reviews Cancer. Faculty 1000 Biology: 10 (Exceptional).
10. Wang, X and Dai, J. Isoforms of OCT4 contribute to the confusing diversity in stem cell biology. Stem Cells. 2010. 28(5):885-93. (Invited Review)
11. Gao, Y., Wang, X. *(* Co-first authors), Han, J., Xiao, Z., Chen, B., Su, G., Dai, J. The novel OCT4 spliced variant OCT4B1 can generate three protein isoforms by alternative splicing into OCT4B. J Genet Genomics. 2010. 37(7):461-5
12. Zhang, J., Wang, X. *(* Co-first authors), Chen, B., Xiao, Z., Li, W., Lu, Y. and Dai, J. The human pluripotency gene NANOG/NANOGP8 is expressed in gastric cancer and associated with tumor development. Oncology Letters. 2010. 1(3):457-463.
13. Wang, X., Zhao, Y., Xiao, Z., Chen, B., Wei, Z., Wang, B., Zhang, J., Han, J., Gao, Y., Li, L., Zhao, H., Zhao, W., Lin, H. and Dai, J. Alternative translation of OCT4 by an internal ribosome entry site and its novel function in stress response. Stem Cells. 2009. 27(6):1265-75.
14. Zhang, J.*, Wang, X.* (* Co-first authors), Han, J., Chen, B., Wang, B., Suo, G. and Dai J. NANOGP8 is a retrogene expressed in cancers. FEBS Journal. 2006. 273(8): 1723-30.

