
清华大学药学院胡泽平课题组应邀发文系统总结了代谢组学和代谢流分析技术的最新研究进展,及其在肿瘤药理学应用中的重要研究进展,包括发现抗肿瘤药物靶点以及生物标记物、揭示药物作用机制和耐药机制、促进精准治疗等。值得一提的是,该综述首次系统地总结绘制了代谢流分析中各种稳定同位素标记示踪物的工作原理及其应用(详见图2),这将为代谢流分析技术在代谢研究领域和肿瘤药理中的广泛应用起到重要的推动作用。
增殖中的肿瘤细胞通常以代谢重塑的方式来提供更多的生物能量和物质,以满足其自身快速增殖的需求。譬如,沃伯格效应(Warburg effect)描述了即便是在有氧的情况下,肿瘤细胞仍然会上调糖酵解途径,并产生更多的乳酸。深入理解肿瘤中的代谢重塑对于我们发现新型治疗靶点,开发抗肿瘤药物有着重大的启示作用;而代谢组学和代谢流技术的发展则极大地促进了我们对于肿瘤代谢的理解。代谢组学能够给我们提供某一静态时刻下的大量代谢物信息,而代谢流分析能够动态地告诉我们某一代谢通路的流量变化。代谢组学和代谢流相辅相成,为我们理解肿瘤代谢打开了全面且动态的崭新视角。
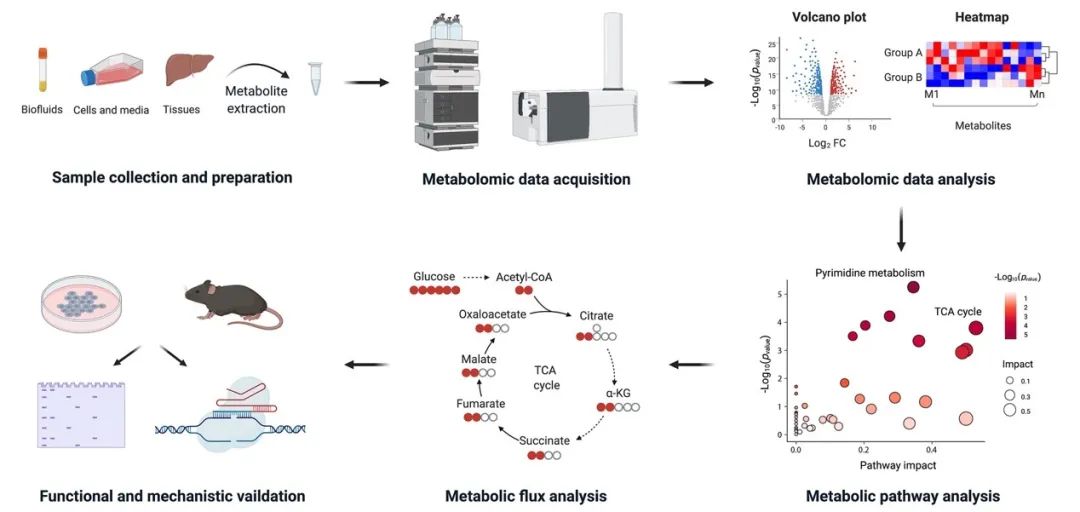
图1. 基于液相色谱-质谱的代谢组学-代谢流分析流程简图
代谢组学分析主要分为三步骤:样品制备、数据采集、和数据处理分析与生物学意义阐释。生物样本经过提取处理后,通过色谱-质谱(mass spectrometry, MS)联用或核磁共振(nuclear magnetic resonance, NMR)来对代谢物进行分析和数据采集。简要数据处理则主要包括通过火山图和热图呈现代谢物的丰度和倍数变化,对代谢物进行通路富集分析。后续则可选择使用同位素标记的代谢流分析来揭示代谢通路的动态变化,并使用体外或者体内模型来进行代谢重塑的功能和机制验证。近年来的代谢组学技术取得一些重要进展,如胡泽平课题组发展的可用于极微量样本(如1,000-5,000个造血干细胞或者60个卵母细胞)的超灵敏代谢组学技术和Sabatini课题组发展的线粒体代谢组学等,都推动了代谢组学在代谢生物学和肿瘤生物学中的应用。
代谢流分析(metabolic flux analysis, MFA)可以动态地揭示代谢通路的流量变化。当一个代谢物产生积累时,可能是由于其生产的增加或者是消耗的减少。基于稳定同位素示踪法的MFA则可以帮助我们测量代谢流量:带有稳定同位素标记的代谢物经过生化反应,则会导致下游代谢产物的标记,产生在特定位置被同位素标记的M+1,…,M+n代谢物。通过分析下游代谢物的标记模式及被标记代谢物的量,我们可以计算得出感兴趣的代谢通路的流量速度和方向信息。
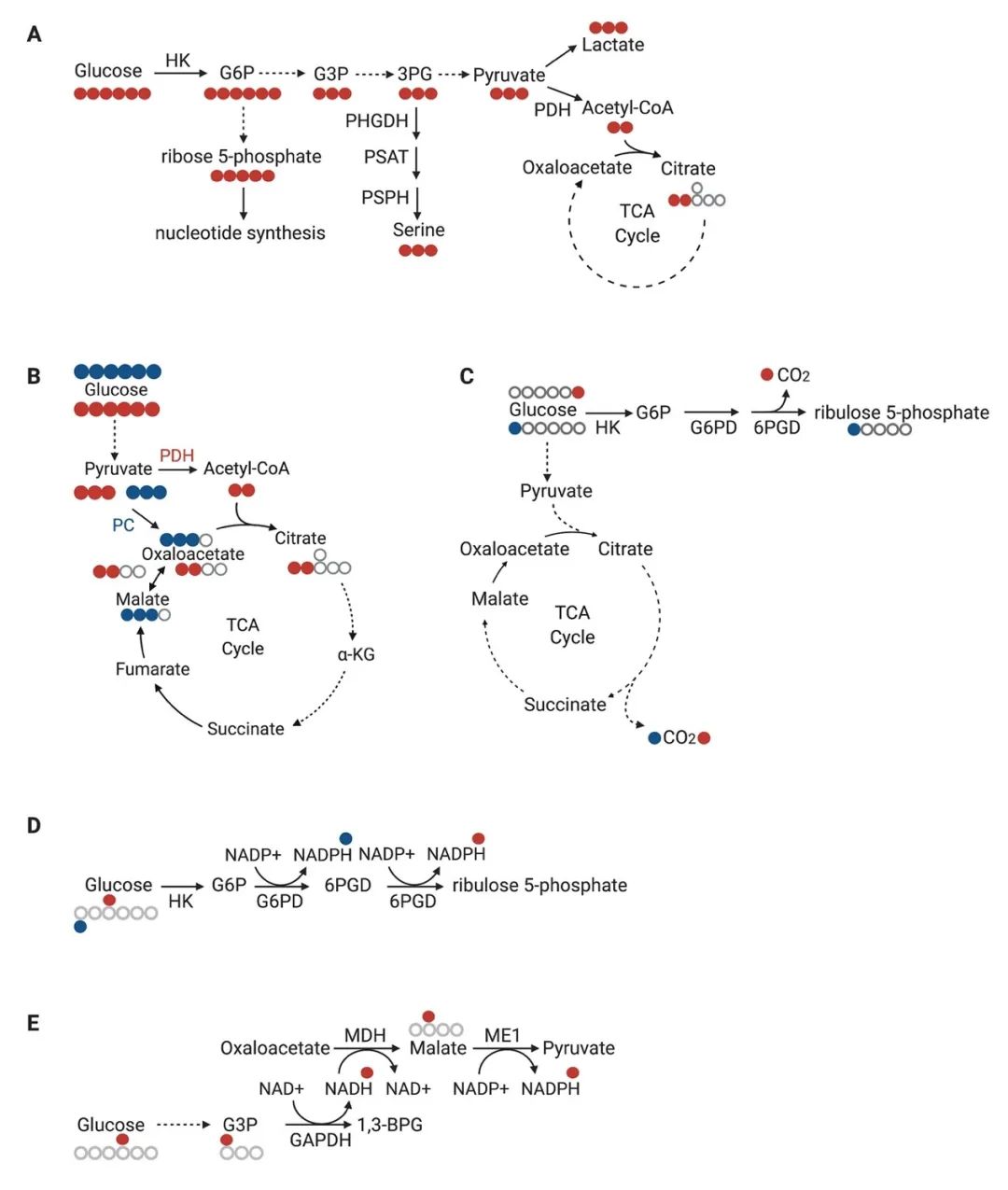
图2. 稳定同位素标记示踪剂标记葡萄糖代谢通路(节选部分)
例如图2(A)中全13C标记的葡萄糖经过糖酵解反应,生成糖酵解终产物丙酮酸。丙酮酸又可经丙酮酸脱氢酶生成乙酰辅酶A,进入三羧酸循环(TCA cycle)。另外,葡萄糖作为磷酸戊糖途径和丝氨酸生物合成的底物,可以标记这两条代谢途径中的中间产物。通过分析特定通路的下游产物标记,我们可以得到在某段时间内的代谢流量。图2(B)则展示了全13C标记的葡萄糖通过糖酵解代谢为丙酮酸后,可以通过丙酮酸脱氢酶和丙酮酸羧化酶两种方式进入三羧酸循环,从而产生M+2以及M+3的TCA中间产物,进而我们可以分析得到两种酶所介导的不同通路信息。
代谢是高度复杂且受严密调控的动态变化网络。除了基于特定酶、转运体的调控外,通路之间可以通过同一中间产物而产生关联。如果能找到肿瘤细胞中相较于正常细胞而特定依赖的代谢通路,那么我们就可以精确地靶向肿瘤细胞进行治疗和干预。
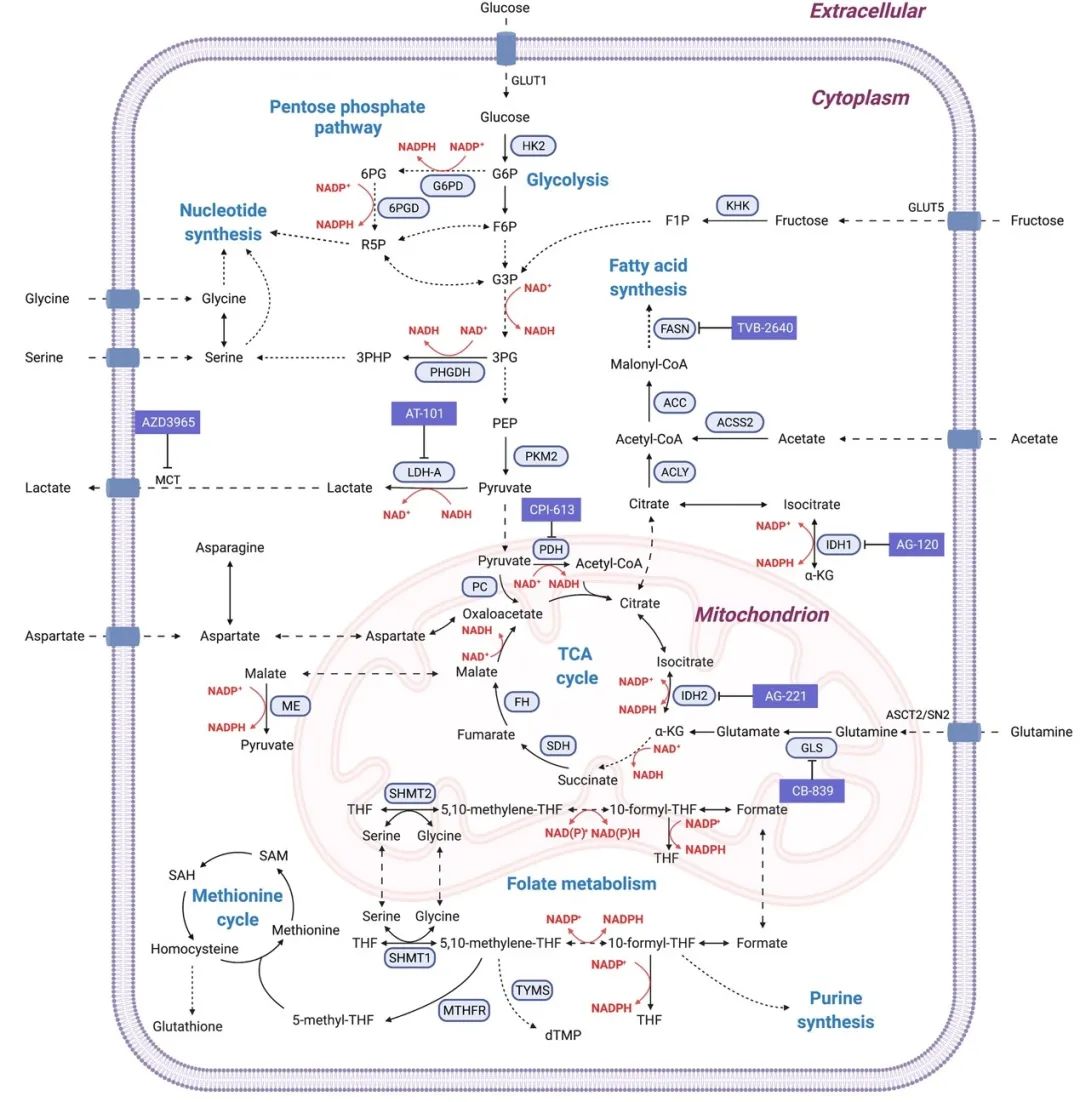
图3. 促进肿瘤细胞生长的代谢通路及潜在治疗靶点
图3.展示了细胞中复杂的代谢通路,包括葡萄糖的代谢(糖酵解、磷酸戊糖途径)、脂肪酸代谢、核苷酸的合成、叶酸代谢等,其中特别标记了值得调控的关键酶和转运体,以及针对这些作为靶标已进入临床试验或者已经被FDA批准的小分子药物。譬如,在胶质瘤中曾报道过突变的异柠檬酸脱氢酶(IDH)可以介导肿瘤代谢物2-羟戊二酸(2HG)的产生,展示了IDH作为抗肿瘤靶标的潜力,从而引发IDH抑制剂的开发、获批与应用。
代谢组学与代谢流分析也可以在肿瘤药物研发中发挥重要作用,并可贯穿于每一步中:从发现靶点到理解药物作用机理,从耐药机制研究到指导精准治疗。
经过代谢组学分析后,差异代谢物和代谢通路可引导发现潜在的生物标记物和可靶向的代谢依赖性和弱点。潜在的生物标记物可帮助肿瘤的早期诊断、预后和药物有效性预测。通过结合代谢流分析,代谢靶标可以帮助新药研发,或者是帮助科研人员更好地理解现有药物的作用机制,以及如何产生耐药,从而改善现有疗法。药理代谢组学可以用于指导精准治疗;饮食干预疗法则可以作为药物治疗的辅助手段。
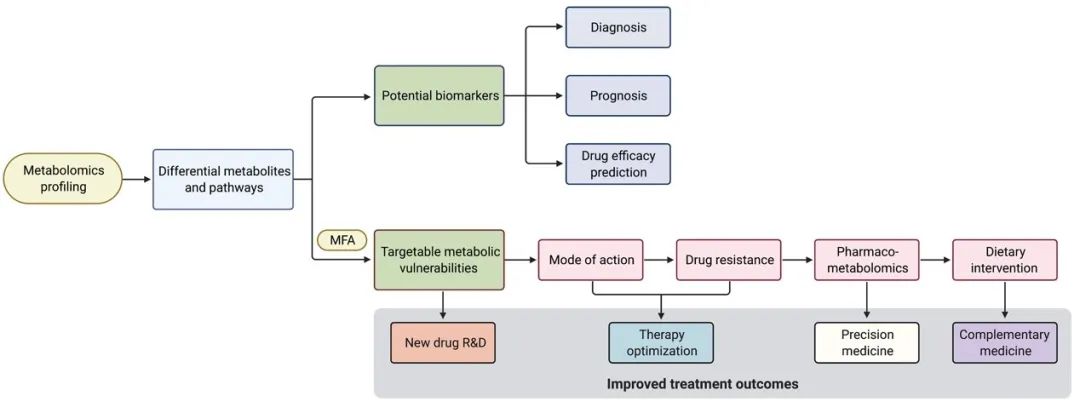
图4.代谢组学和代谢流分析技术在肿瘤药物研发和药理学中的应用
尽管代谢组学和代谢流分析极大拓展了我们对于肿瘤生物学的理解,但是领域中依旧存在诸多技术挑战和瓶颈,比如灵敏度不足、精准度不够、难以进行代谢流分析,以及至今无法实现真正意义上的单细胞代谢组学(特别是由于灵敏度的技术瓶颈)等等。相关的技术进步和新型方法开发都将进一步促进代谢组学和代谢流分析技术在不同生物医学背景下的应用。下一阶段的研究需要更好地整合、利用所获取的代谢重塑表型和机制信息,将其转化成更好的抗肿瘤疗法。药物研发方面需要更多地关注肿瘤微环境,尤其是肿瘤细胞与免疫细胞之间的代谢相互作用。多组学整合的应用,包括基因组学、蛋白组学、代谢组学等,将有助于加深我们对于肿瘤生物学的理解和利用,进一步加速抗肿瘤药物的研发。
以上综述文章于2021年3月1日应邀在线发表于国际知名学术期刊《药理学&治疗》(Pharmacology & Therapeutics),题为《代谢组学、代谢流分析与肿瘤药理学》(Metabolomics, metabolic flux analysis and cancer pharmacology),此前,胡泽平课题组曾于2019年获邀在国际知名临床药理期刊《临床药理学&治疗》Clinical Pharmacology & Therapeutics发表代谢组学技术及其在临床药理中应用的相关综述。
清华大学药学院胡泽平研究员与烟台大学药学院王洪波教授为本文通讯作者,2016级药学院本科毕业生梁凌帆与胡泽平课题组2020级博士研究生孙菲分别为本文第一、第二作者。本研究得到了国家自然科学基金委糖脂代谢重大计划重点项目(92057209)、基金委面上项目(81973355)、国家科技部重点研发计划(2019YFA0802100-02, 2020YFA0803300)、清华-北大生命科学联合中心、北京市高精尖结构生物学中心的资助。
点击链接,阅读原文:https://www.sciencedirect.com/science/article/abs/pii/S0163725821000292


