2021年3月8日,清华大学药学院钱锋课题组应邀在药物递送领域的国际知名期刊《Advanced Drug Delivery Reviews》在线发表题为《靶向胰腺癌相关成纤维细胞的药物递送:机遇与困境》(Opportunities and delusions regarding drug delivery targeting pancreatic cancer-associated fibroblasts)的综述论文,系统总结了胰腺癌肿瘤微环境中肿瘤相关成纤维细胞(cancer associated fibroblast, CAF)的来源,分类,和复杂的生物学功能(详见图1);总结了不同研究开发阶段的CAF相关药物靶点及相应的药物候选物;梳理了针对胰腺癌CAF进行药物递送的核心要点、设计原则和关键挑战;总结了潜在可能应用于各类CAF相关药物的递送系统,并对靶向CAF药物递送的未来研究方向进行了讨论和展望。
CAF的定义与来源
试图准确定义CAF,是我们面临的第一个难题。由于缺乏特异性生物标志物,对CAF的定义目前仍然没有定论。在实际研究中,研究者们通常这样描述CAF:位于肿瘤组织中;不表达上皮细胞,内皮细胞和白细胞的标志物;具有细长的形态;没有癌细胞中发现的基因突变。
由于CAF是一个来源复杂的,高度异质性的群体,在缺乏特异性生物标志物的情况下,想要精确研究肿瘤发生过程中,CAF的来源、形成、招募和迁移也是一项极具挑战的任务。通过分析已经形成的CAF所表现出来的特征和功能,研究者们推测CAF可能来源于内皮细胞、正常的纤维细胞、骨髓来源的间充质干细胞,等。在胰腺癌中,胰腺星形细胞(Pancreatic stellate cell, PSC)被认为是CAF最重要的来源之一。
胰腺癌CAF:肿瘤微环境中的多面手
胰腺癌,因其预后极差而被人们称为“癌症之王”。肿瘤患者的临床用药已经从最初的细胞毒药物,逐步发展出选择性更好的小分子靶向抑制剂和免疫疗法;而胰腺癌的治疗仍然严重依赖化疗,对小分子靶向抑制剂和免疫疗法的响应性非常低。研究者们认为高度纤维化、免疫抑制的肿瘤微环境是造成这一局面的重要原因。
CAF是胰腺癌肿瘤微环境中的重要组分,它的重要性直观地体现在数量上:胰腺癌的肿瘤细胞仅占肿瘤微环境的10-20%,外周被大量的CAF包围;更体现上在功能上:CAF分泌多种生长因子、外泌体、氨基酸等支持肿瘤细胞的生长和代谢;分泌多种趋化因子和细胞因子抑制抗肿瘤免疫(如图1)。正是由于CAF的重要功能,研究者们试图通过干预CAF来重塑肿瘤微环境,解决胰腺癌的耐药问题,并激活抗肿瘤免疫反应。
棘手的问题是,胰腺癌CAF是一个异质性很高的群体。研究认为分布在TME中不同位置的CAF分属不同亚群:紧邻肿瘤细胞的CAF,表达高水平的α-SMA,被称为肌成纤维细胞(myCAF); 远离肿瘤细胞的CAF,以分泌炎性因子为特征,被称为炎性成纤维细胞(iCAF)。更重要的是,CAF的功能也表现出异质性:胰腺癌中可能同时存在“肿瘤促进”和“肿瘤抑制”的亚群,已有研究表明在动物模型中完全清除myCAF会导致肿瘤进展加快;抑制myCAF增殖的小分子IPI-926在临床实验中也折戟沉沙。
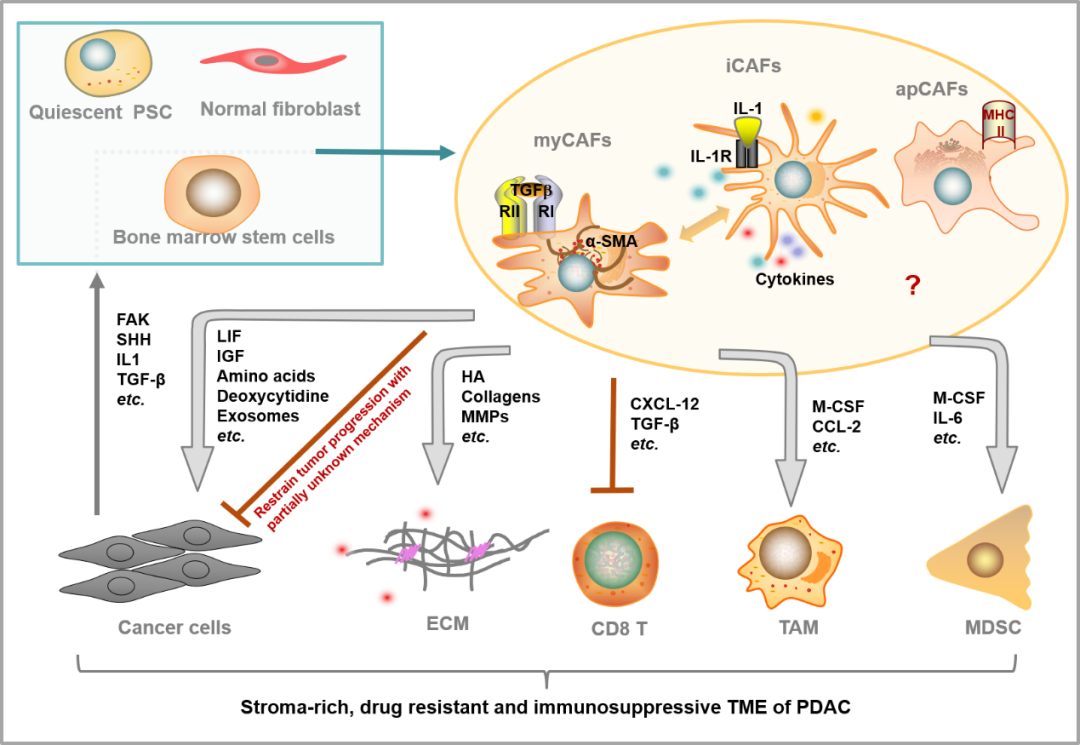
图1 胰腺癌CAF的来源、亚型和复杂功能
“递送什么”:多样的药物靶点和药物候选物
药物递送工作有两个方面的问题需要考虑:首先,我们选择要递送的药物分子,然后考虑如何递送所选的药物分子。在设计任何药物递送策略之前,都需要先仔细考虑“递送什么”的问题:诸多潜在的药物靶标和候选药物中,哪一个最有可能是正确的那个? 例如,由于CAF通过多种生物学机制导致耐药性,我们必须先找到这其中最重要的核心机制,确定相应的CAF靶向药物分子,才有希望增加胰腺癌对化疗或免疫疗法响应性。
随着人们对CAF生物学机理的理解不断深入,与CAF相关的药物靶点相继被发现。总体而言,针对CAF的治疗策略根据其药物靶点的位置不同可大致分为三类:第一,直接针对CAF。例如,据报道,某些化合物(例如反式维甲酸,维生素D类似物等)能够以部分已知的机制调节CAF内的多种细胞途径,使活化的CAF逆转为静息状态。其次,抑制负责CAF相关crosstalk的可溶性蛋白。例如,阻断由CAF产生和分泌的、具有肿瘤促进或免疫抑制功能的细胞因子(例如CXCL12)。第三,抑制介导CAF相关crosstalk的细胞表面受体(例如CXCR4)。上述针对CAF的治疗策略不断有候选药物分子在临床前和临床研究中被评估,遗憾的是,至今尚未有成功上市的药物产品。
“如何递送”:靶向CAF药物递送的线索与困境
为了优化药物递送的选择性,开发安全有效的药物,应根据选定的药物分子的特性和需求设计药物递送策略。CAF相关的药物候选物有不同的形式(可以是小分子或生物大分子),有着不同的药理作用机理,药代动力学性质,药学理化性质(分子大小,溶解度和稳定性等),作用靶标位置也各不相同(例如细胞外,细胞膜,细胞内),这些都是在设计药物递送系统之前必须综合考虑的关键因素。因此,不同的CAF靶向药物需要“量身定制”的递送系统。
根据一些临床前和临床研究发现,一些药物递送系统可能有肿瘤蓄积效果。胰腺癌的临床药物中有两款使用了复杂药物制剂技术:紫杉醇白蛋白纳米粒和伊利替康脂质体,这两种剂型都被报道能够增加药物在肿瘤内的蓄积或滞留(动物模型数据)。此外,也有一些实验室阶段的早期研究报道了可以在肿瘤微环境中选择性释放药物或能被CAF选择性内吞的药物递送系统(如图2),不过这些早期研究能否真正用于胰腺癌CAF的靶向药物递送还需在更临床相关的动物模型中进一步评估。
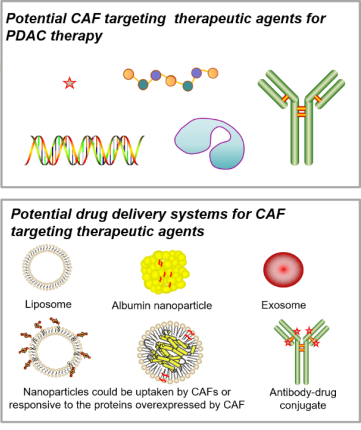 图2.不同类型的药物候选物以及潜在的药物递送系统
图2.不同类型的药物候选物以及潜在的药物递送系统
CAF的异质性和可塑性为药物递送带来了挑战。例如,研究表明α-SMA+ myCAF可能存在抑制肿瘤侵袭转移的功能,在设计靶向CAF的药物递送系统时,可能需要区分“增强肿瘤”和“抑制肿瘤”的CAF。但由于缺乏独特的生物标记物,将药物靶向递送到PDAC TME中的某些CAF亚型仍然难以实现。另一个难点是CAF的可塑性:所谓的亚型是可逆的细胞状态,而不是终末分化。当受到邻近细胞的相互作用,旁分泌因子调节甚至机械信号改变时,CAF的亚型都可能发生改变,因此靶向促癌CAF特定亚群的治疗机会可能是时间依赖性的,这对药物递送的精确性提出了更高的要求。
清华大学药学院钱锋研究员和索尔克生物研究所(Salk Institute for Biological Studies)Yu Shi博士为本文通讯作者,钱锋组博士后刘慧琴为本文第一作者。钱锋研究组开展的针对胰腺癌的药物输送研究获得了中国国家自然科学基金(项目号82073769),北京结构生物学高精尖中心的资助。
原文链接:https://www.sciencedirect.com/science/article/pii/S0169409X21000582


