2020年10月23日, 清华大学药学院、结构生物学高精尖创新中心刘翔宇课题组与清华大学医学院Brian Kobilka课题组及合作者在《Cell Research》期刊上以长文形式报道了题为“结合途径决定去甲肾上腺素对人源β肾上腺素受体的亚型选择性”(Binding pathway determines norepinephrine selectivity for the human β1AR over β2AR)的研究论文。首次解析了人源β1肾上腺素受体在非激活态和激活态的晶体结构,包括结合内源配体去甲肾上腺素和肾上腺素的结构,并发现配体结合受体的结合途径决定了去甲肾上腺素对β肾上腺素受体的亚型选择性。
1. 去甲肾上腺素q亲和力差异研究
G 蛋白偶联受体是最大的膜受体蛋白家族,在人类基因组中有 800 多个成员, 调控着重要的生理功能。β肾上腺素受体属于G蛋白偶联受体家族,受交感神经系统调控,被去甲肾上腺素和肾上腺素激活,参与调节如心跳、呼吸等关键的生理过程,也是研究G蛋白偶联受体的经典模型。β肾上腺素受体包含β1肾上腺素受体、β2肾上腺素受体、β3肾上腺素受体三个亚型。激素(hormone)肾上腺素对 β1 和 β2 肾上腺素受体具有相近的亲和力,而神经递质(neurotransmitter)去甲肾上腺素对于 β1 肾上腺素受体亲和力比 β2 肾上腺素受体高了 10 倍左右。两个内源配体对受体的不同选择性对于调控心脏的生理活动具有重要意义。去甲肾上腺素和肾上腺素的分子式十分相似,只有一个甲基的不同。而β1 和 β2 肾上腺素受体结合天然配体的所有氨基酸都是一模一样的。去甲肾上腺素为什么会在两个完全保守的配体结合口袋具有10倍的亲和力差异,是一个困扰了研究界四十多年的问题。
2. 探究内源配体对beta受体亚型选择性的动态学机制
为了探究内源配体对β肾上腺素受体亚型选择性的分子机理,研究者将人源β1 和 β2 肾上腺素受体的胞外区互换,构建了两个嵌合受体(图1)。通过动力学结合实验发现决定去甲肾上腺素对人源β肾上腺素受体亚型选择性的主要影响因素是配体进入受体口袋的速度(结合速率)。
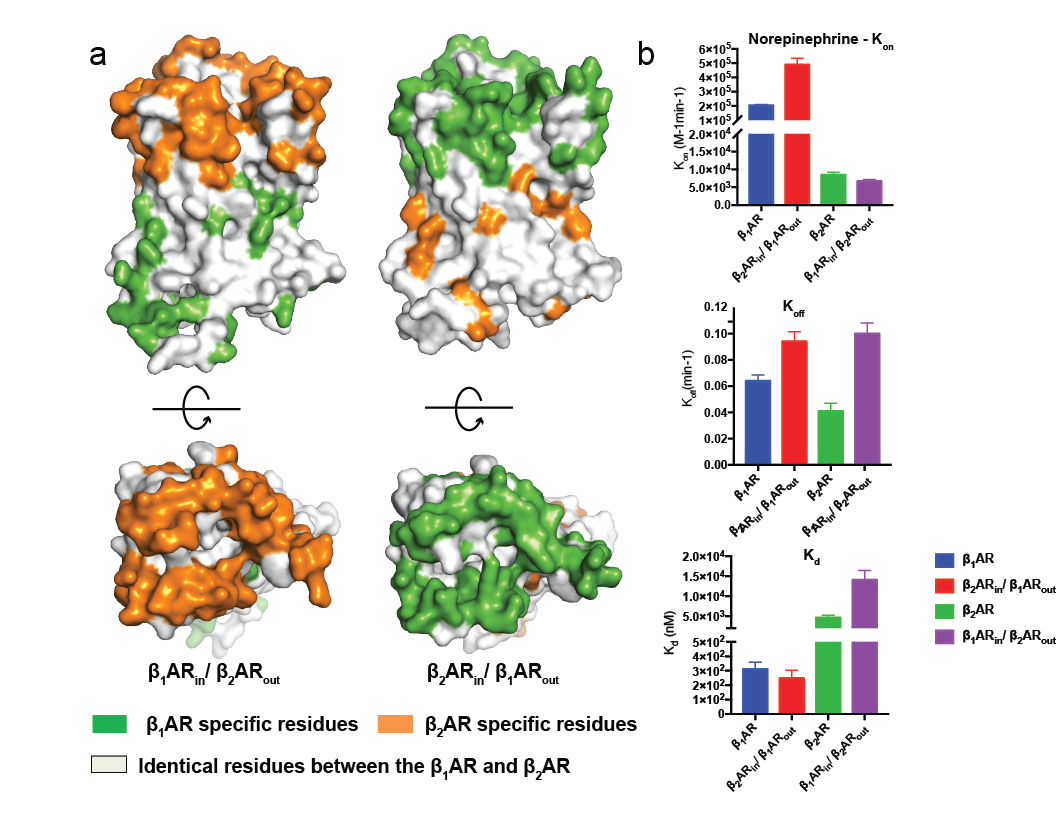
图1. 去甲肾上腺素结合β肾上腺素受体的动力学研究
a.嵌合受体的设计 b. 去甲肾上腺素结合野生型β1、β2肾上腺素受体及嵌合受体的动力学研究
3. 揭示受体胞外区决定去甲肾上腺素亚型选择性的分子机理
为了进一步阐明β肾上腺素受体不同的胞外区对甲肾上腺素亚型选择性的影响,研究组解析了人源β1 肾上腺素受体的晶体结构,包括了结合抑制剂Carazolol的结构和结合超强激动剂BI-167107的结构,以及结合两个内源配体去甲肾上腺素和肾上腺素的结构。通过结构比对发现,β1肾上腺素受体和β2肾上腺素受体具有相似的配体结合口袋和不同的胞外区表面。结合分子模拟与突变实验的结果,研究者发现去甲肾上腺素通过不同的结合途径进入β1肾上腺素受体和β2肾上腺素受体的正构配体结合口袋。两个途径中不同的关键氨基酸影响了去甲肾上腺素的结合速率和亲和力,决定了其选择性。而肾上腺素虽然也通过不同的结合途径进入β1肾上腺素受体和β2肾上腺素受体,但是肾上腺素在化学结构上比去甲肾上腺素多一个甲基,该甲基引起电性的不同导致肾上腺素对两个受体不具有选择性(图2)。研究者首次在分子机理上阐明受体的胞外区如何作为“选择性滤网”,决定了配体对受体的亚型选择性。这项工作也拓宽了GPCR亚型选择性药物开发的思路,可以不局限于针对保守性较高的正构配体结合口袋,而考虑保守性较低的胞外区“选择性滤网”。
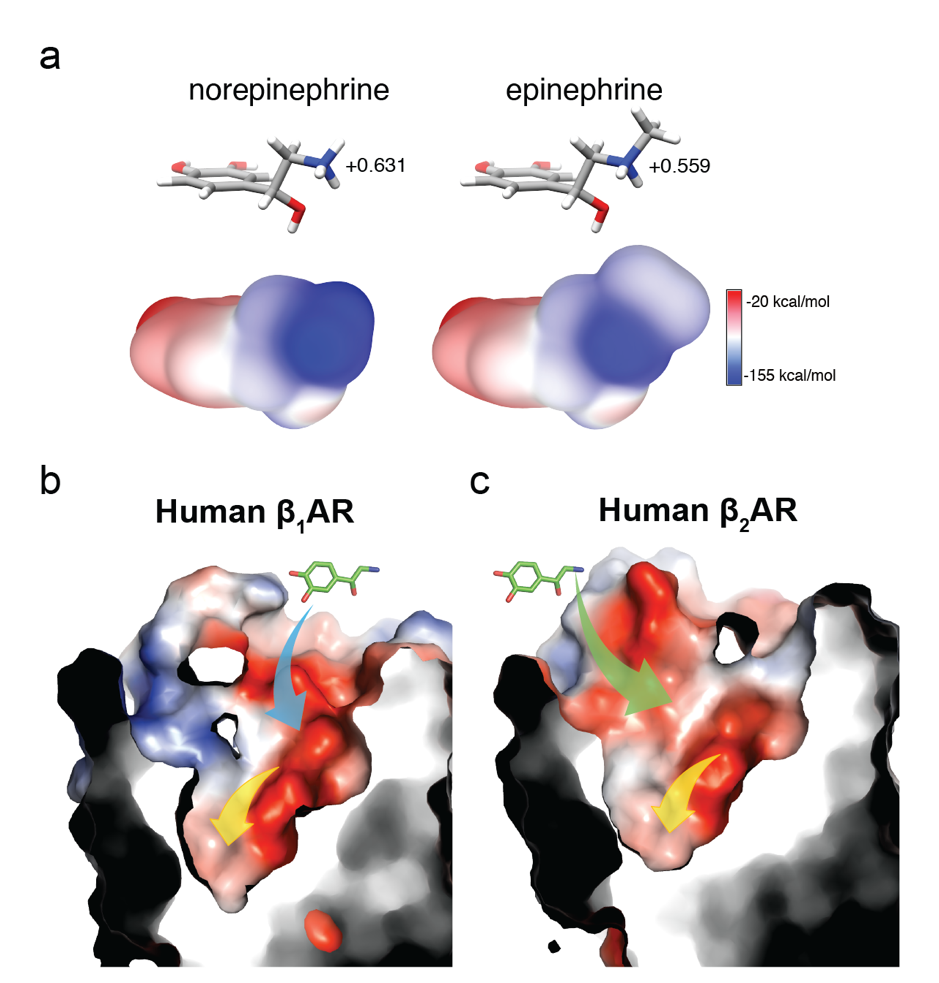
图2. 去甲肾上腺素在β1肾上腺素受体和β2肾上腺素受体中不同的结合途径
a. 去甲肾上腺素和肾上腺素的化学结构和电性分析。
b. 去甲肾上腺素在β1肾上腺素受体中的结合途径是一个连续的带负电的通道。
c. 去甲肾上腺素在β2肾上腺素受体中的结合途径是由两块带负
电的区域和一个电中性的间隔连接形成的。
清华大学药学院刘翔宇教授、加州大学圣地亚戈分校药理学系Roger Sunahara教授以及德国弗里德里希-亚历山大-埃尔朗根-纽伦堡大学化学与药理学系的Peter Gmeiner教授为本文的共同通讯作者。清华大学Brian Kobilka课题组许心宇博士、德国弗里德里希-亚历山大埃尔朗根-纽伦堡大学Peter Gmeiner课题组Jonas Kaindal博士及加州大学圣地亚戈分校Roger Sunahara课题组Mary J. Clark博士为本文共同第一作者。本课题得到了北京市结构生物学高精尖创新中心的资助以及清华大学生物医学测试中心同位素实验室的技术支持。


