北京时间2020年1月22日,以
“A High-Fat Diet Reverses Metabolic Disorders and Premature Aging by Modulating Insulin and IGF1 Signaling in SIRT6 Knockout Mice”为题在衰老领域顶级专业期刊Aging Cell杂志上在线发表了王钊教授课题组最新研究成果。此文报道了高脂饮食通过干预胰岛素信号通路改善了SIRT6缺陷小鼠的代谢异常,有效减缓了其多组织器官萎缩等机体过度消耗表征,明确挽救早衰表型并显著延长寿命,为临床针对衰老终末期或疾病终末期患者的营养制定、改善患者生存质量和延长健康寿命提供了重要的科学依据。
人类从出生到死亡,体能仿佛经历了一个循环。从婴儿时期的虚弱到成年时期的强壮,又再次不可避免地迎来高龄时期体能的衰弱。即使身体无重大疾病,在高龄状态下各组织器官也会出现结构异常及功能下降,如肌肉量减少(肌少症,Sarcopenia)、脂肪异常分布、骨密度下降、心肾衰竭等;在多种恶性消耗性疾病的中后期,例如肿瘤、败血症、艾滋病患者,身体也容易出现多组织器官萎缩,功能紊乱,临床上被定义为恶病质(Cachexia)。以上症状均与代谢异常综合征相关。目前,临床上用于治疗Sarcopenia和Cachexia的方案主要包括运动、营养和药物三个方面。运动在大部分个体中很难有效的实现;通过增加氨基酸摄入维持肌肉功能,在临床实践中表明效果有限,还易为肾脏带来过大负担;针对萎缩相关蛋白(Ghrelin, Myostatin)设计的阻断剂具有一定的改善作用,但收效甚微。因此可行性强、效果显著的方法仍有待发掘。
清淡饮食?纯素食?多吃粗粮?一定有助于健康吗?该研究表明,老年人尤其是衰老末期一定要注意补充脂肪类食物。
该研究结果提示,高脂饮食能够通过提高机体脂代谢、降低糖代谢,进而系统性干预机体代谢模式,改善疾病或衰老终末期的恶病质状态,提高机体的生存质量并延长寿命。大家以往对于高脂饮食的认知,多认为其是众多疾病的罪魁祸首,包括肥胖、糖尿病、脂肪肝以及肿瘤等,在这些研究中所提及的高脂饮食几乎全部伴随着过多的食物摄入和过度的热量摄入。然而高脂饮食并不等同于高热量饮食,本文所提倡的高脂饮食是指在适当降低食物摄入、控制热量正常摄入的情况下,提高三大营养元素中脂肪的比例而降低碳水化合物的比例,探究高脂饮食对于糖代谢异常以及组织、器官萎缩的影响。
作为组蛋白的去乙酰化酶和核糖转移酶,
SIRT6在多个物种中保守表达,参与了多个基因的表达调控以及信号通路的激活,进而影响了多个重要的生物过程。
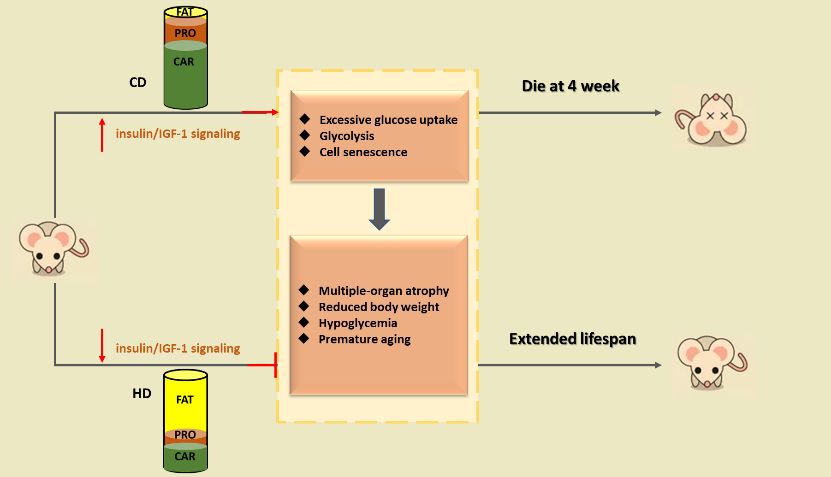
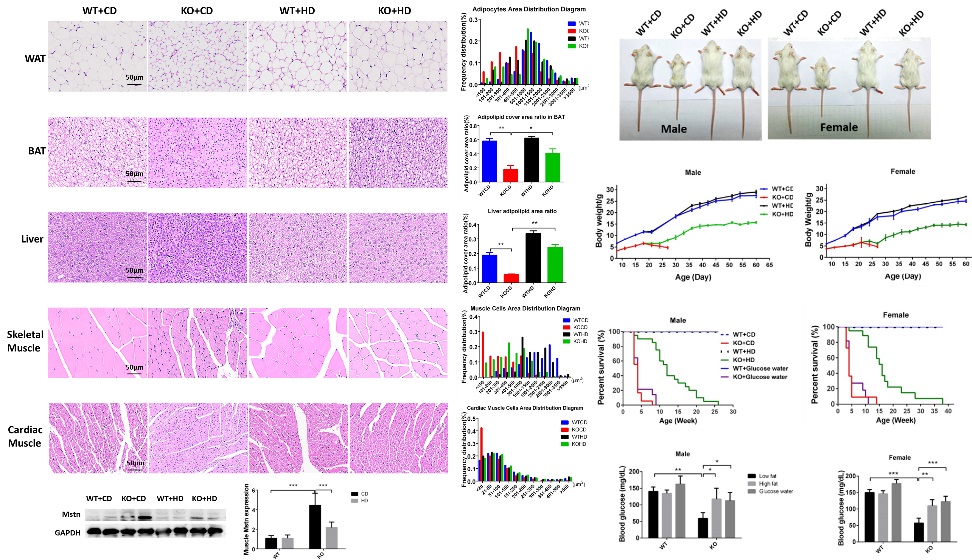
SIRT6缺陷小鼠呈现机体代谢异常,出生后4周左右死亡,组织器官严重萎缩。研究者发现,高脂饮食能够延长小鼠寿命最长达8倍多!同时,高脂饮食还能够缓解糖代谢异常、改善组织器官的萎缩和诸多衰老表型等。
脂肪的摄入能够抑制Insulin/IGF-1信号通路的过度激活,减弱细胞对于葡萄糖的过度吸收和糖酵解过程,改善由于
SIRT6缺陷所致的糖代谢异常以及衰老表型,其中肌肉组织的响应优于肝脏和褐色脂肪。同时,研究者实验证明了在细胞中具体发挥作用的是脂肪酸而非酮体(酮体为脂肪酸在肝脏中的代谢产物)。
进一步的,研究者分别探究了不同类型脂肪酸对于Insulin/IGF-1信号通路以及糖酵解的抑制作用,结果发现多种脂肪酸都能够发挥作用。
本研究首次提出
SIRT6缺陷小鼠可以作为衰老终末期研究模型,高脂饮食可以有效减缓衰老终末期的代谢异常、多组织器官萎缩等机体过度消耗表征并挽救由此带来的寿命损失。研究者从具体的分子层面解释了脂代谢对于机体的保护作用。本课题中所提出的营养饮食方案主要针对衰老以及慢性消耗性疾病终末期阶段个体,为老年个体膳食指南以及临床应用提供了重要的理论依据。


