2020年4月17日,清华大学药学院王建伟团队在血液学专业期刊《BLOOD》杂志发表题为“衰老激活的IL27Ra信号损伤造血干细胞”(Aging-induced IL27Ra Signaling Impairs Hematopoietic Stem Cells)的研究论文,首次报导炎症因子TNFα通过ERK→ETS1→IL27Ra信号通路导致造血干细胞衰老,并且证明IL27Ra是人和鼠造血干细胞新的表面标记物,可以用来分离功能更强的造血干细胞。
衰老和衰老相关疾病是人口老龄化时代人类需要应对的重大挑战,在快速更新的组织中,组织的衰老起始于干细胞的衰老。造血干细胞(Hematopoietic Stem Cells,HSC)是最早被发现的成体干细胞,它主要定位于骨髓,能够向下游分化为所有血液细胞并保持自我更新的能力,以维持整个生命周期的血细胞供应。临床上,HSC移植(造血干细胞移植)已经被广泛应用于临床治疗中。在衰老过程中,HSC的功能逐渐衰退,主要表现为:数目增加,重建血液系统的能力减弱,同时具有髓系分化倾向。HSC的衰老是老年贫血和老年髓系白血病高发的原因之一。
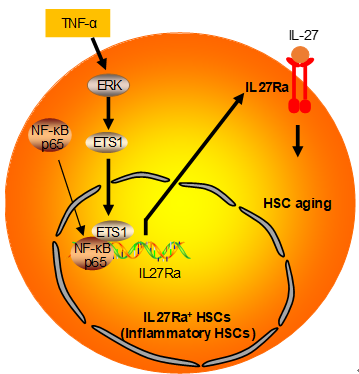
关于HSC衰老的分子机制研究,以往的工作主要关注于内源机制,如DNA损伤、表观遗传紊乱、线粒体损伤等。基于HSC定位于骨髓,其功能受到骨髓微环境的影响这一特点,王建伟实验室通过细胞因子受体筛选的方法,发现并证明IL27Ra是HSC的表面标记物,并阐明了衰老所导致的骨髓炎症微环境通过TNF→ERK→ETS1→IL27Ra通路
在本文中,王建伟团队首先通过数据库筛选,初步锁定了7个在年老HSC中表达上调的细胞因子受体。通过进一步的流式细胞术确认,发现上述7个受体中只有IL27Ra在年老HSC中表达上调。根据IL27Ra的表达,HSC可以分为两群:IL27Ra+ HSC和IL27Ra- HSC。通过竞争性移植实验,研究者发现:无论在年轻还是年老的小鼠中,IL27Ra- HSC功能都显著强于IL27Ra+ HSC。通过更严格的单细胞移植实验,研究者证明IL27Ra可以作为HSC的表面标记物,用于分选功能更强的HSC。值得一提的是,IL27Ra在老年人的HSC中也同样上调,且体外克隆形成实验表明,IL27Ra同样可以作为人类HSC 表面标记物用于分选功能更强的HSC。
Q: 既然IL27Ra表达上调导致了HSC功能衰退,那么阻断IL27Ra信号,是否能延缓HSC衰老呢?
A: 为了回答这一问题,研究者引入了IL27Ra敲除小鼠,对血液系统的分析表明:在年轻小鼠中,IL27Ra信号缺失不影响血液系统发育;但随着时间的积累,IL27Ra-/-小鼠的血液系统逐渐展现出“年轻化”的表型:与年龄匹配的野生型老年小鼠(18-28月龄)相比,IL27Ra-/-小鼠HSC表现出更强的重建血液系统的能力,且分化更均衡。
Q: 衰老上调的IL27Ra导致了HSC功能衰退,那么是什么原因导致了衰老过程中IL27Ra的上调呢?
A: 为了回答这一问题,研究者对IL27Ra进行了启动子区筛选,发现翻译起始位点上游-75bp至-120bp区段是IL27Ra的核心启动子区,通过生物信息学分析来预测转录因子,联合染色质免疫共沉淀(ChIP)实验验证,证实ETS1和NF-κB p65是激活IL27Ra表达的转录因子。进一步的实验表明,年老HSC中,ETS1及其上游ERK信号的活性显著强于年轻HSC,而NF-κB p65信号未见显著变化,说明衰老过程中ERK-ETS1信号的激活是导致IL27Ra上调的关键原因。为了进一步探究ERK→ETS1→IL27Ra上游的信号,研究者利用细胞因子芯片技术比较了年轻和年老小鼠骨髓中细胞因子含量,发现年老小鼠骨髓中呈现炎症状态,通过对年老上调的炎症因子进行筛选,研究者锁定了肿瘤坏死因子(TNFα),并证实TNFα是激活ERK-ETS1最终导致IL27Ra表达上调的关键因子。
Q: 以上结果表明炎症因子TNFα通过ERK-ETS1激活了IL27Ra的表达,而IL27Ra的激活又是如何损伤造血干细胞的呢?
A: 研究者对IL27Ra- HSC和IL27Ra+ HSC进行了转录组分析(RNA-seq),发现IL27Ra+ HSC中炎症基因的表达更为活跃,这些基因的表达使得IL27Ra+ HSC呈现出炎症状态最终导致功能衰退。
Q: 最后,生理状态下,IL27Ra+ HSC的功能是什么呢?
A: 研究者对野生型和IL27Ra-/-小鼠进行LPS刺激,用于模拟炎症状态。实验发现,LPS刺激下,野生型小鼠HSC迅速扩增,同时IL27Ra+ HSC的比例也急剧增加,表明IL27Ra+ HSC是作为应对炎症的干细胞储备。与野生型小鼠相比,IL27Ra-/-小鼠HSC在LPS刺激下扩增能力更弱,表明IL27Ra可以作为传感器(sensor)分子响应炎症信号,促使HSC大量扩增。
至此,研究者阐明了衰老相关的慢性炎症通过TNFα→ERK→ETS1→IL27Ra通路损伤HSC的分子机制。同时,IL27Ra作为HSC表面标记物这一发现为临床上分离纯化功能更强的HSC提供了思路。最后,研究者证明IL27Ra是HSC应对外界炎症信号的传感器基因,找到了炎性衰老引发HSC衰老的内源机制。
王建伟团队博士研究生何汉卿、徐庞连、张潇飞为本文共同第一作者,王建伟研究员为本文通讯作者。本项目受到了国家重点研发计划、国家自然科学基金委、北京市科委及生命科学联合中心等多个项目的资助。


