近日,清华大学药学院杨悦课题组该基于中美两国在创新药专利期延长和药品试验数据保护制度方面的差异,对 2018 年至 2021 年在我国和美国获批上市小分子创新药的首个适应症的专利期延长(PTE)时间和药品试验数据保护期进行了评估。
其中,美国获批药品的PTE长度提取自美国专利商标局数据库,我国获批药品的PTE长度为通过模拟计算获得(我国药品专利补偿制度于2021年6月1日起施行)。
研究分别纳入我国和美国获批的 32 种和 107 种小分子创新药。结果表明我国批准新药的模拟PTE长度中位数显著高于美国批准的创新药(5.0年vs. 2.9年,P<0 .05)。我国实施专利期延长制度以后将显著延长创新药的市场独占期,并且与美国没有显著差异。该研究建议我国应充分评估pte政策对创新药市场独占期的潜在影响,制定更加具有激励效果的药品试验数据保护制度,以解决未满足的临床需求。
(1)中美两国PTE计算方法模拟的结果具有显著相关性。我国和美国的PTE计算方法如图1所示。为评估我国和美国PTE计算方法的差异,该研究分别采用我国和美国的PTE计算方法对中美两国获批创新药进行模拟分析(图2)。模拟结果显示中美两国PTE计算方法的结果具有良好的线性关系,说明中美两国PTE计算方法具有显著相关性。此外,采用中国PTE计算方法可能获得更长的PTE长度。
图1. 中国和美国创新药PTE的计算方法
图2. 我国和美国PTE计算方法模拟两国创新药的PTE长度比较
(2)我国创新药获得的PTE显著长于美国创新药的PTE。该研究进一步对中美两国获批创新药的上市后关键专利有效期(通常为化合物专利;EPPL)、PTE和EPPL+PTE进行分析(图3)。结果发现中美两国在EPPL方面没有显著差异,但我国创新药获得的PTE显著长于美国创新药的PTE。中美两国在EPPL+PTE长度方面没有明显差异。
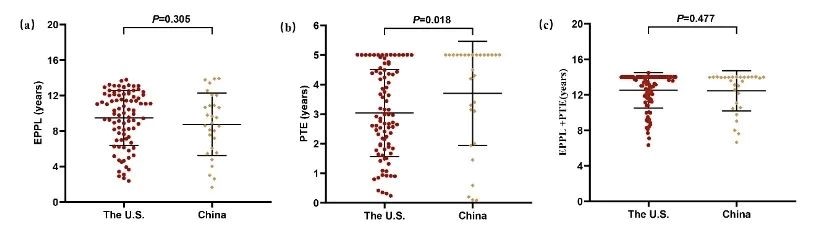
图3. 中美两国创新药的EPPL、PTE和EPPL+PTE长度比较
(3)我国的创新药有效专利期均长于其试验数据保护期。该研究评估了有效专利期和药品试验数据保护期对创新药市场独占期潜在的影响(图4)。模拟结果显示,在不考虑专利挑战情况的条件下,我国创新药的有效专利期均大于药品试验数据保护期(根据我国2018年发布的《药品试验数据保护实施办法》(征求意见稿),给予化学创新药6年试验数据保护期)。与我国相比,美国药品试验数据保护制度更为灵活,其激励效果更加明显。因此,该研究建议我国应充分评估PTE政策对创新药市场独占期的影响,结合我国未满足的临床需求,制定更加具有激励效果的药品试验数据保护制度。
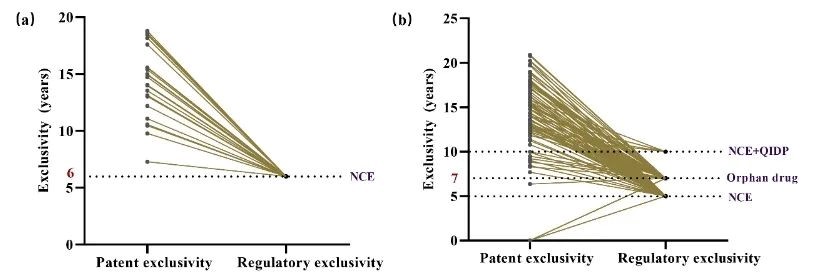
图4. 有效专利期和药品试验数据保护期对中美两国创新药市场独占期的影响
上述研究在美国临床药理学与治疗学学会的旗舰期刊《Clinical Pharmacology & Therapeutics》在线发表,标题为《中美两国创新药专利期延长和试验数据保护制度的分析:一项关于2018-2021年批准的新药队列研究》(Analysis of patent and regulatory exclusivity for novel agents in China and the U.S.: A cohort study of drugs approved between 2018-2021)。
《Clinical Pharmacology & Therapeutics》是临床药理学领域的权威期刊。本文通讯作者为清华大学药学院杨悦研究员,第一作者为清华大学药学院博士后罗兴献。感谢药学院钱锋副院长课题组对该研究提供的帮助和支持。该项研究得到了清华-北京大学生命科学联合中心基金的项目经费支持。
原文链接:https://ascpt.onlinelibrary.wiley.com/doi/10.1002/cpt.2625


