清华大学药学院刘刚教授团队及合作者最近报道了结直肠癌细胞分泌的细胞外囊泡(CRC-EVs)通过激活 NOD 样受体1(NOD1),促进结直肠癌肝转移。研究以“Extracellular vesicles from colorectal cancer cells promote metastasis via the NOD1 signaling pathway”为题,于2022年9月7日在 《Journal of Extracellular Vesicles》期刊在线发表。该研究首次发现巨噬细胞内的 NOD1 被CRC-EVs携带的高含量的小 G 蛋白CDC42蛋白激活后诱导了多种炎症因子趋化因子分泌,并促进了结直肠癌转移。
NOD1 / 结直肠癌的诱发与研究现状
结直肠癌(colorectal cancer,CRC)是高发病率和高死亡率的恶性肿瘤之一。据报道,超过 50%的CRC患者发生肝转移,是CRC患者死亡的主要原因之一。模式识别受体(pattern-recognition receptors, PRRs)是机体抵御炎症和感染性疾病的第一道防线。NOD1, 作为细胞内模式识别受体中的一种, 主要表达于单核细胞、巨噬细胞、树突状细胞以及中性粒细胞中,可识别革兰氏阴性细菌及少部分革兰氏阳性细菌细胞壁的降解产物iE-DAP,识别配体并被激活后的NOD1可进一步诱导受体相互作用蛋白2(RIP2)发生磷酸化、泛素化,激活下游与炎症相关的NF-κB和MAPKs信号通路,促进炎症的产生。已有研究发现,激活NOD1可促进骨髓来源抑制性细胞(myeloid-derived suppressor cells,MDSCs)的聚集,诱导肿瘤相关巨噬细胞(Tumor-Associated Macrophage, TAM)向 M2 极化, 从而形成有利于肿瘤发生及转移的免疫抑制型微环境。然而,肿瘤细胞如何操控免疫细胞的NOD1信号通路, 促进其发生转移未见报道。
EVs (CRC-EVs) / 激活与诱导
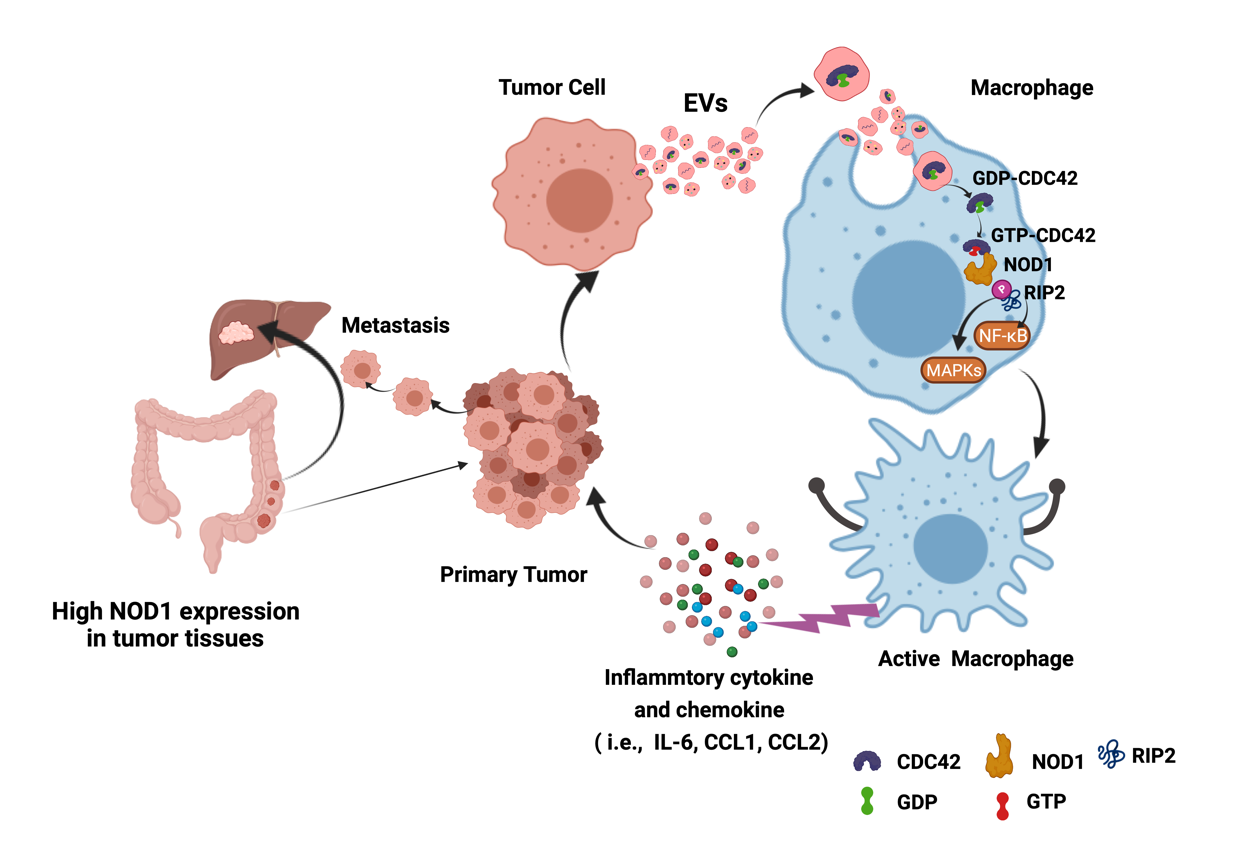
该研究首先发现,CRC 细胞分泌的 EVs (CRC-EVs)可特异性激活巨噬细胞中 NOD1,并诱导RIP2蛋白发生磷酸化,促进下游与炎症相关的NF-κB 信号通路中的 p65磷酸化,激活NF-κB 信号通路;同时,磷酸化的RIP2 蛋白也促进了 MAPKs信号通路中的 p38发生磷酸化,激活了p38-MAPKs信号通路(图 1)。进一步实验发现CRC-EVs激活巨噬细胞中 NOD1 信号通路后,可诱导其分泌多种炎症因子和趋化因子,如 IL-6、CCL1、CCL2 等,促进肿瘤细胞迁移。在体内实验中也发现,小鼠敲除 NOD1 基因后可显著降低CRC-EVs诱导的结直肠癌肝转移现象(图 2)。

图1.
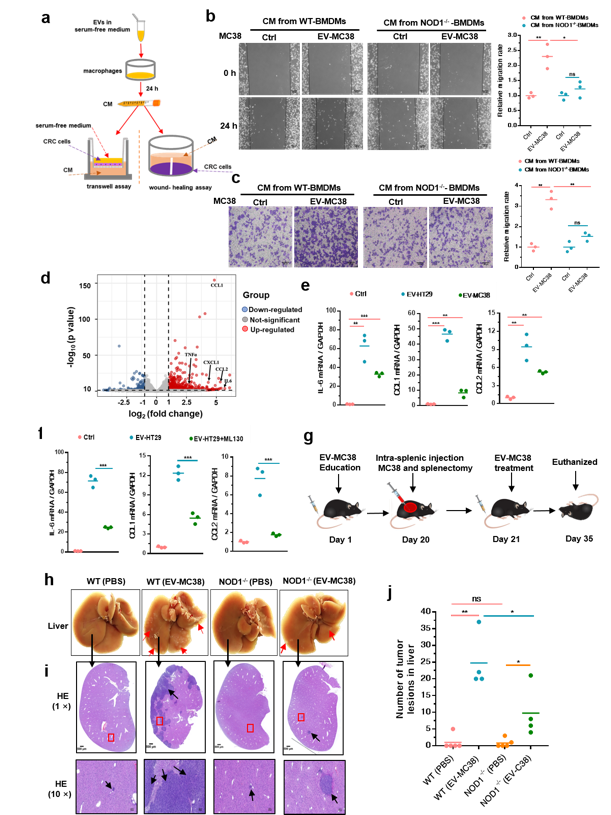
图2
CRC-EVs 激活 NOD1 信号通路(图 1)并促进CRC 细胞发生转移(图 2)
利用蛋白质组学技术,该研究深入探讨了正常结肠细胞和结直肠癌细胞分泌的EVs中蛋白的差异,发现CRC-EVs携带了较高含量的CDC42(图3),当EVs被肿瘤微环境中的巨噬细胞摄取进入细胞后,以活化态形式GTP-CDC42激活NOD1的信号通路,促进肿瘤细胞迁移(图4)。

图3
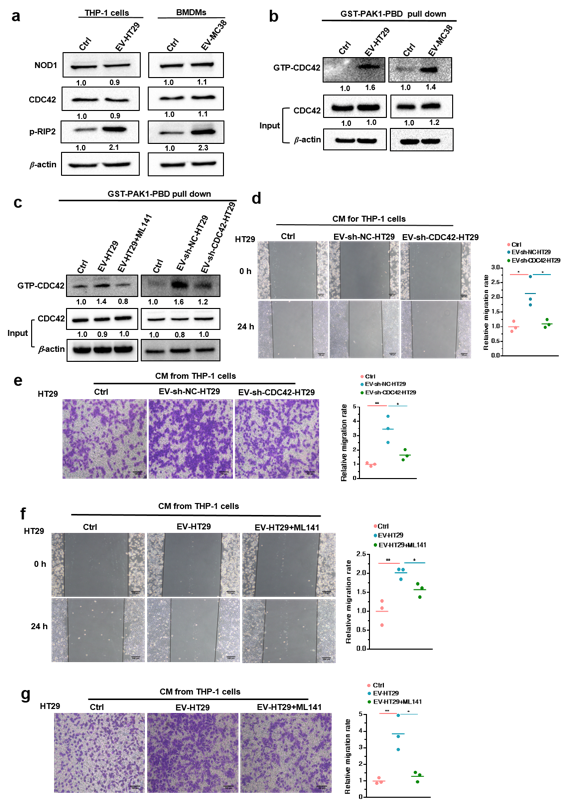
图4
CRC-EVs 中的 CDC42 介导NOD1 信号通路的激活(图 3)并促进 CRC 细胞发生转移(图 4)
为验证CRC-EVs 激活NOD1信号通路与临床结直肠癌患者肝转移的相关性,研究团队分离了结直肠癌肝转移(CRC-LM)患者外周血来源的EVs,发现其同样激活人外周血单核细胞(PBMCs)的 NOD1 信号通路。研究进一步发现,CRC-LM患者来源的 EVs中同样含有较高水平的 GDP-CDC42,诱导了患者PBMCs中NOD1信号通路的激活,是结直肠癌发生肝转移的潜在诱因之一 (图 5)。通过对GEO数据库中与结直肠癌相关的组织芯片临床信息分析发现,CRC-LM患者原位癌组织样本中NOD1的含量显著高于非转移患者,并且肝转移癌组织中NOD1的表达量更明显高于原发灶肿瘤组织,这一分析结果也在临床样本的检测中得到了验证(图6)。利用对 TCGA 和 GEO 中结直肠癌相关的组织芯片信息进行生存分析,研究团队进一步发现在肿瘤组织中NOD1高表达与临床预后较差具有密切相关性,证实了NOD1 在 CRC 肝转移中的重要作用(图 6)。
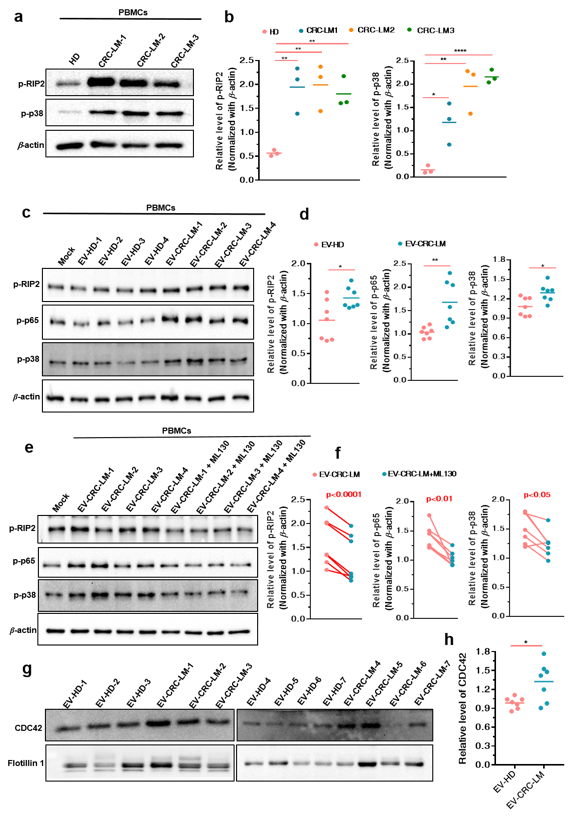
图5
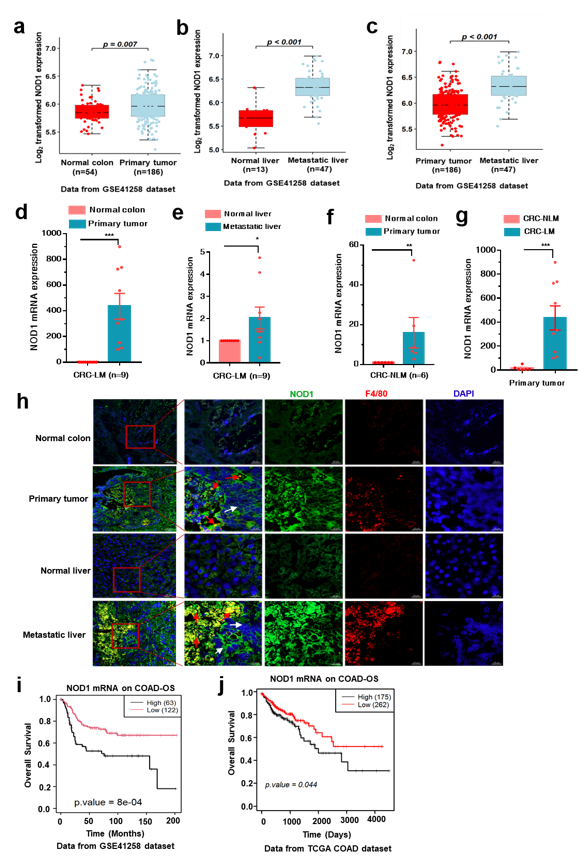
图6
CRC 患者血浆中的 EVs NOD1 信号通路的激活(图 5);
NOD1在肿瘤组织中高表达,促进 CRC发生肝转移并与临床预后较差具有密切相关性(图 6)
综上,该研究工作发现CRC-EVs携带了较高含量的CDC42,当EVs被肿瘤微环境中的巨噬细胞摄取后,以活化态形式GTP-CDC42激活NOD1的信号通路,刺激巨噬细胞分泌多种炎症因子和趋化因子,如 IL-6、CCL1、CCL2 等,形成有利于结直肠癌转移的炎症微环境,促进结直肠癌转移。
清华大学药学院刘刚教授、北京大学肿瘤医院王崑副教授、中国医学科学院药物研究所马瑶博士为该论文的通讯作者,刘刚课题组博士后韦细端为该论文第一作者,刘刚课题组叶景佳同学、裴亚蒙博士后等在该课题组实施过程中提供了大量的帮助。
感谢清华大学质谱平台、生物技术平台、动物中心提供的技术支持,感谢国家自然科学基金项目(81803358, 81703329, 81273364, 82003568, 81773114)经费支持。
清华大学药学院刘刚教授团队多年来一直致力于研究 NOD 受体在肿瘤发生、发展及治疗中的作用,针对 NOD受体参与化疗药物治疗肿瘤的研究取得了一系列的结果,发表了系列相关研究论文,并开发出多种NOD 受体特异性拮抗剂,部分正在进行临床试验。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/jev2.12264


