近日,清华大学药学院杨悦课题组在美国临床药理学与治疗学学会的旗舰期刊《Clinical Pharmacology & Therapeutics》在线发表了题为《中美两国抗肿瘤创新药上市迟滞的分析:对比2010-2021年批准的新药》(Assessment of the delay in novel anticancer drugs between China and the United States: a comparative study of drugs approved between 2010-2021)的研究论文。
抗肿瘤药物迟滞(英文称为Drug lags;定义:药品在两个国家或地区批准的上市时间差)问题一直是各国关注的焦点。我国于2015年启动药品审评改革,包括建立加快通道(优先审评、附条件批准、突破性疗法和特殊审批)、60天药物临床试验申请默认许可制、接受境外临床试验数据等,这对加快抗肿瘤创新药在我国上市,提高患者的用药可及性发挥了重要作用。
该研究通过分析2010-2021年在美国(FDA)批准的抗肿瘤创新药,以日本 (PMDA)和欧盟(EMA)作为对照组,评估这些抗肿瘤创新药在中国(NMPA)药物迟滞的变化。研究结果显示在2010-2021年期间,FDA共计批准123个抗肿瘤新分子实体(244个适应症),其中,NMPA、PMDA以及EMA分别批准58个(94个适应症)、72个(128个适应症)以及99个(170个适应症)。与2010-2015年相比,2016-2021年(即药品审批审评改革后)我国抗肿瘤创新药的绝对迟滞(定义:以美国批准的抗肿瘤创新药和适应症为参照,我国未批准抗肿瘤创新药和适应症的数量)和相对迟滞显著减少(定义:以美国批准的抗肿瘤创新药和适应症为参照,我国批准相同抗肿瘤创新药和适应症的时间差)。近年来,我国抗肿瘤创新药审评耗时已经显著短于欧盟,与日本耗时相当。然而,我国抗肿瘤创新药在上市申请阶段迟滞(即NDA提交申请晚于美国的时间)仍然显著长于日本和欧盟。尽管我国在减少抗肿瘤创新药的绝对和相对迟滞方面成效显著,但在美国2010-2021年批准的抗肿瘤创新药中,有53%的新分子实体和61%的新适应症仍未在我国获得批准。
我国的抗肿瘤创新药审评时间已接近国际水平
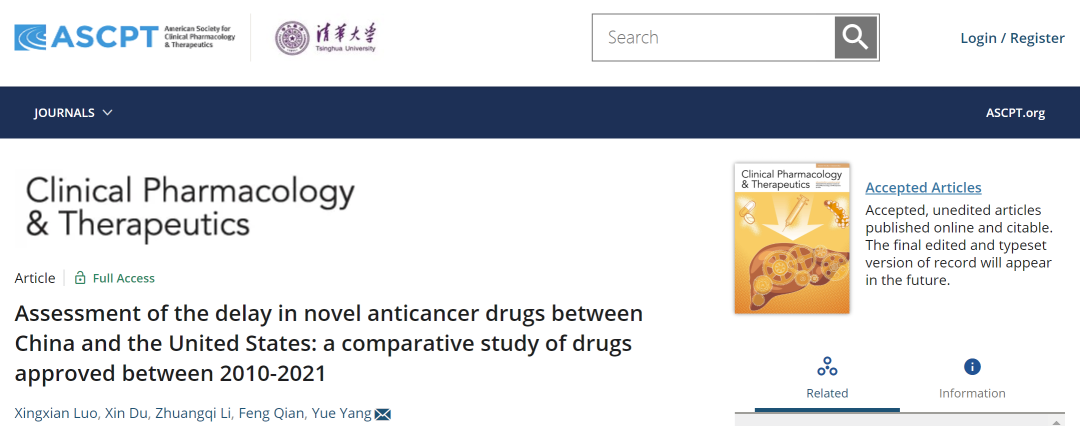
在抗肿瘤创新药审评时间方面,美国的中位数审评时间最短,为207天。我国中位数审评时间为345天,显著短于欧盟(428天),与日本较为接近(280天)(图-1)。
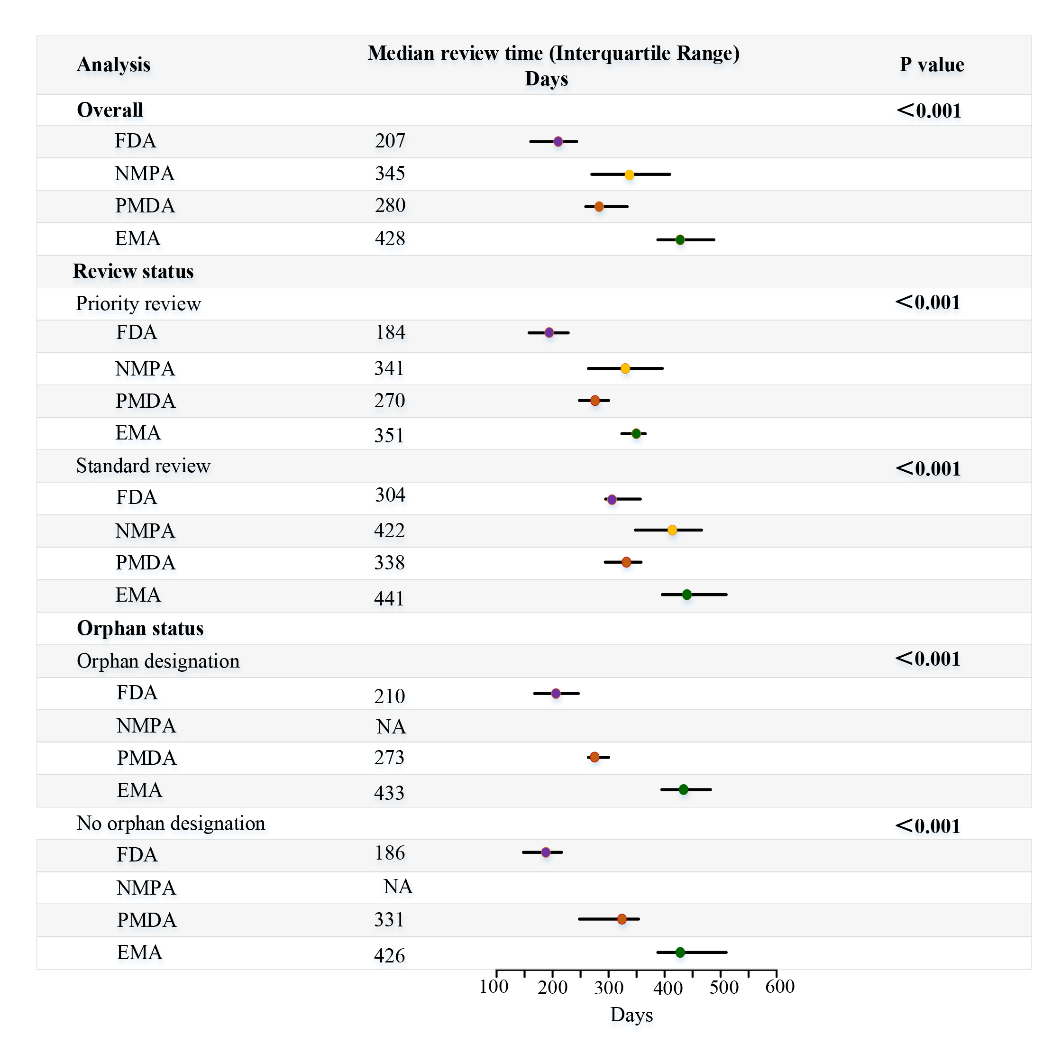
图-1 对比中国、美国、日本和欧盟的抗肿瘤创新药审评时间差异
2. 我国在减少抗肿瘤创新药的绝对和相对迟滞方面取得重要成效
自2015年启动药品审评审批改革,我国批准的抗肿瘤创新药和适应症数量逐年增长(图-2)。同时,上市迟滞呈现逐年递减趋势。我国的抗肿瘤创新药上市迟滞从2010-2015年(以FDA批准时间为参照)的65个月降至2016-2021年的32个月(图-3)。这些数据支持我国近年来在加快抗肿瘤创新药上市方面取得的重要成效。
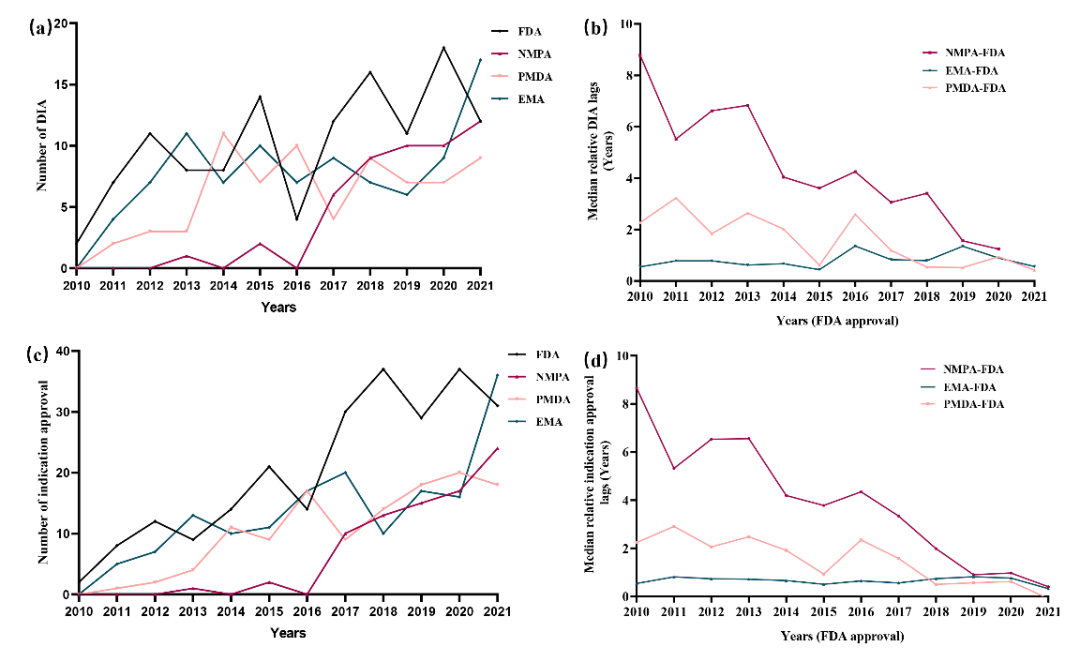
图-2 对比中国、日本和欧盟抗肿瘤创新药上市迟滞的变化
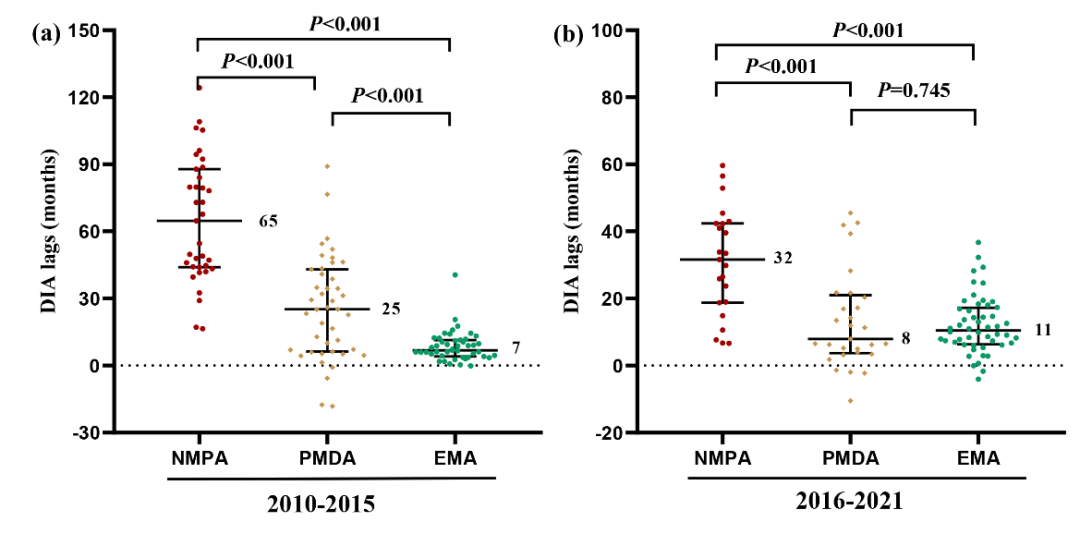
图-3 对比中国、日本和欧盟抗肿瘤创新药上市迟滞的差异
3. 我国抗肿瘤创新药上市申请迟滞有待进一步改善
在抗肿瘤创新药审评迟滞方面,我国已经与日本相当(120天 vs. 60天; P=0.06),并且显著短于欧盟(120天 vs. 226天;P<0.01)。然而,在上市申请迟滞方面,我国显著长于日本(28个月 vs. 6个月;P<0.001)和欧盟(28个月 vs. 1个月;P<0.001)(图-4),提示我国应当采取相应措施以减少抗肿瘤创新药的上市申请迟滞。
图-4 对比我国、日本和欧盟抗肿瘤创新药审评和上市申请迟滞的差异图-4 对比我国、日本和欧盟抗肿瘤创新药审评和上市申请迟滞的差异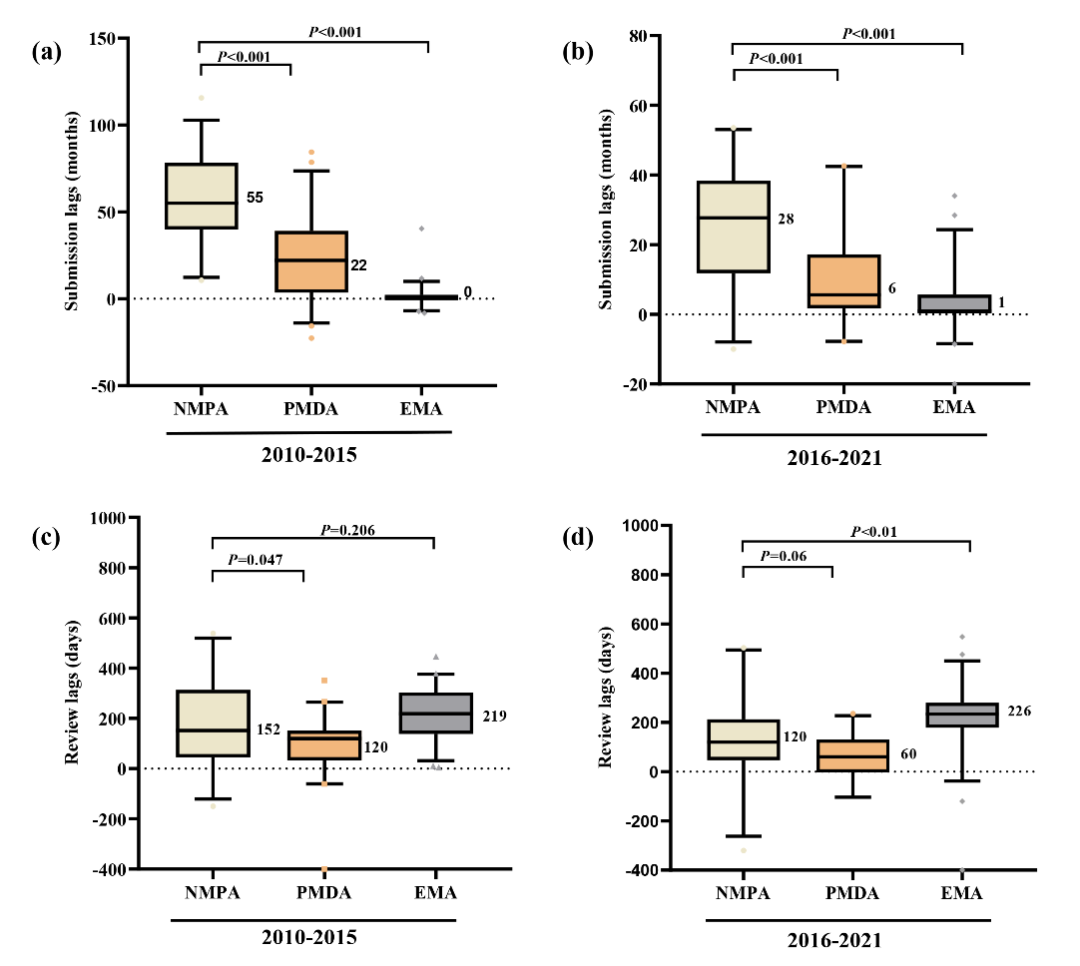
图-4 对比我国、日本和欧盟抗肿瘤创新药审评和上市申请迟滞的差异
4. 我国应当关注部分仍存在明显上市迟滞的抗肿瘤创新药
相比于其他肿瘤领域,用于治疗尿路上皮癌、肾细胞癌、甲状腺癌、肉瘤和子宫内膜癌等领域的抗肿瘤创新药存在明显上市迟滞。因此,建议我国应充分评估这些疾病领域抗肿瘤创新药的临床价值,以加快获批上市,惠及更多患者。
本文第一作者为清华大学药学院博士后罗兴献,通讯作者为清华大学药学院杨悦研究员,感谢药学院钱锋院长课题组对该研究提供的帮助和支持。该项研究得到了清华-北京大学生命科学联合中心基金的项目经费支持。


