近年来,胰腺癌的发病率呈明显的上升趋势,每年约有1%的上升。据美国癌症协会2022年统计数据显示,胰腺癌患者五年的生存率仅为11%。胰腺癌位居男性恶性肿瘤发病率第 10位,女性第 8 位,占恶性肿瘤相关死亡率的第 4 位[1]。患者在临床就诊时大部分已为中晚期,患有不可切除的局部晚期或转移性疾病。随着影像、病理、外科手术技术、抗肿瘤药物、药物递送手段等的不断发展,胰腺癌的诊断、治疗迎来了不少机遇与进步。

近期,清华大学药学院钱锋课题组在《Journal of Controlled Release》发表题为“Albumin binding revitalizes NQO1 bioactivatable drugs as novel therapeutics for pancreatic cancer”的科研论文[2,3],报道了白蛋白结合型NQO1生物激活的药物,可以显著抑制胰腺癌小鼠模型的肿瘤生长,是一种治疗胰腺癌的潜在创新疗法。
NAD(P)H:醌氧化还原酶1(NQO1)是一种双电子氧化还原酶,在多种肿瘤中高度富集。NQO1生物激活药物,例如β-lapachone,具有独特的醌结构,被NQO1催化后生成活性氧(ROS)导致未修复的DNA损伤和细胞程序性坏死。然而,由于用药后严重的急性毒性反应,包括溶血性贫血和高铁血红蛋白血症等,使其在不同癌症类型的尝试中以失败告终。此外,β-lap会迅速从血液中清除,并表现出非特异性药物分布,导致肝细胞内出现空泡等组织损伤,使肿瘤部位药物浓度低,治疗效果不佳[4,5]。本研究旨在探讨如何通过胰腺癌自身的生物学特征,通过递送系统的合理设计达到扩大药物治疗窗的目的。
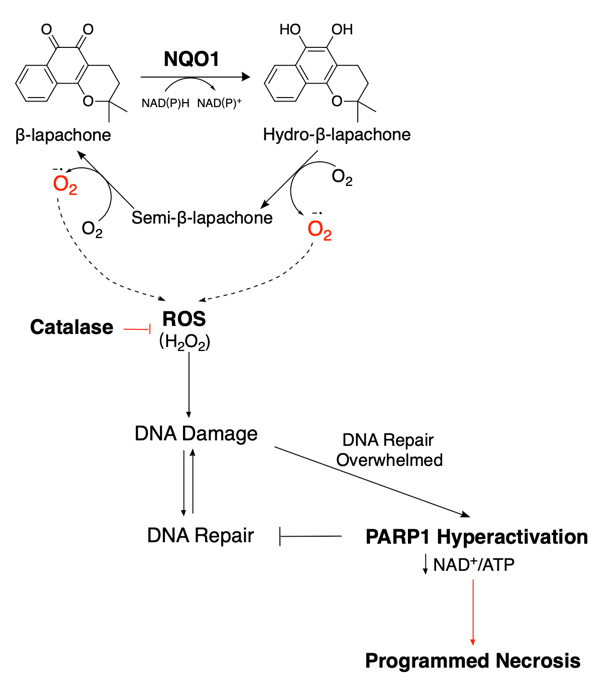
图1. β-lap作用机制图
钱锋教授团队致力于白蛋白递送系统的研究和转化工作。在之前的研究中,利用KRAS突变的胰腺癌细胞增强的巨饱饮作用以及新生儿Fc受体(FcRn)降低促进的白蛋白降解,将小分子与白蛋白偶联后选择性地将其递送到KRAS突变的胰腺导管癌中,从而大大提高了细胞毒性药物的治疗窗口[6]。
在本研究中,作者通过分析LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx-1-Cre (KPC)胰腺癌模型小鼠主要器官(心、肝、脾,肺、肾,正常胰腺,癌前病变组织,肿瘤组织)中白蛋白和 FcRn 的表达情况,发现肿瘤部位具有明显的白蛋白富集,同时 FcRn 表达水平显著降低,由此可见,白蛋白成为靶向胰腺癌肿瘤部位的理想递送系统。对5名胰腺癌患者的组织样本进行的定量蛋白质组学和免疫荧光分析,进一步证实了,相比癌旁正常胰腺组织,肿瘤部位具有升高的白蛋白/FcRn 比率。
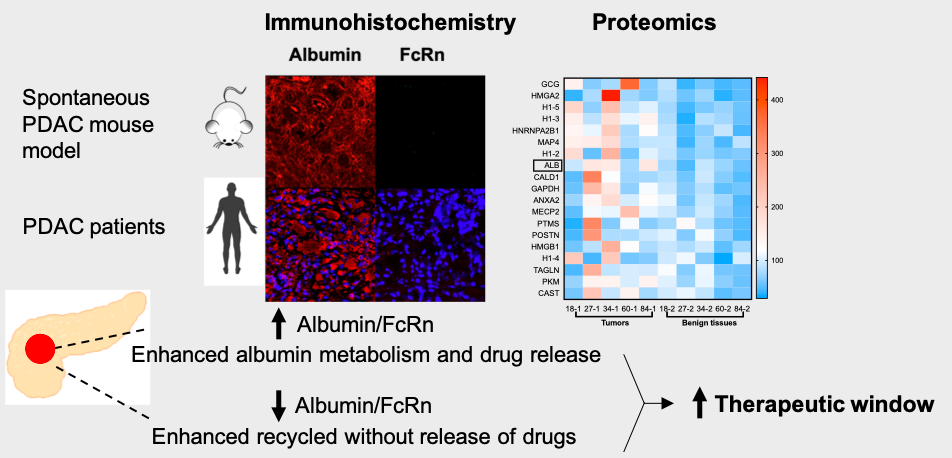
图2. 白蛋白和FcRn在KPC小鼠和胰腺癌患者中的表达情况
基于胰腺癌自身展现的这种生物学特征,团队设计了一种白蛋白结合型的的 β-lap 前药,通过皮下移植的 KPC 小鼠模型充分开展了药效分析及药物安全性评估,实现了 PDAC 靶向递送并扩大 β-lap 的治疗窗口,为β-lap在胰腺癌的治疗提供了一种具有转化可行性的药物递送策略。
KRAS 突变的胰腺癌细胞显着增强了对白蛋白结合型前药的摄取。与母体药物 β-lap 的溶液制剂相比,由于高铁血红蛋白血症和溶血性贫血的发生率降低而显示出更高的安全性,在体外和体内都得到了证实。此外,显着抑制了KPC 皮下移植瘤模型小鼠的肿瘤生长并增强药效学终点(例如,PARP1 过度激活,γ-H2AX)。因此,这种具有更高安全性和抗肿瘤功效的白蛋白结合型β-lap的前药为β-lap在胰腺癌的治疗提供了一种具有转化可行性的药物递送策略。
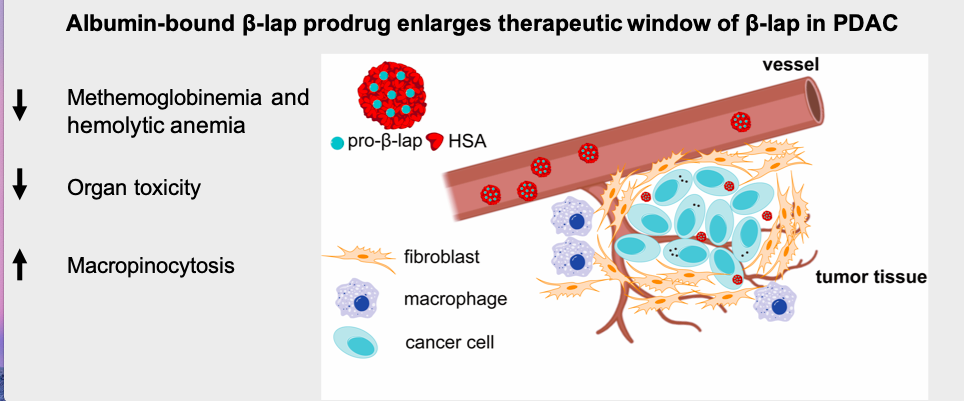
图3. 白蛋白结合型β-lap前药
清华大学药学院钱锋教授是论文通讯作者,药学院博士生豆蕾和博士后刘慧琴是本文的共同第一作者。衷心感谢北京肿瘤医院和北京大学沈琳教授提供的胰腺癌患者组织样本、清华大学生命科学学院邓海腾教授在蛋白质组学方面提供的帮助。博士生王开新、博士后刘磊、叶俊晓、博士生王睿、邓海腾教授实验室刘静博士也参与了该项研究的部分工作。本研究得到了国家自然科学基金(项目编号82073769)和北京市结构生物学高级创新中心的支持。
参考文献:
1. Cancer Facts & Figures 2022, American Cancer Society, 2022.
2. L. Dou, H. Liu, K. Wang, J. Liu, L. Liu, J. Ye, et al. Albumin binding revitalizes NQO1 bioactivatable drugs as novel therapeutics for pancreatic cancer, J. Control. Release 349 (2022) 876-889.
3. L. Dou, H. Liu, K. Wang, J. Liu, L. Liu, J. Ye, et al. Albumin binding revitalizes NQO1 bioactivatable drugs as novel therapeutics for pancreatic cancer, J. Control. Release 350 (2022) 787-788.
4. D.E. Gerber, M.S. Beg, F. Fattah, A.E. Frankel, O. Fatunde, Y. Arriaga, et al., Phase 1 study of ARQ 761, a β-lapachone analogue that promotes NQO1-mediated programmed cancer cell necrosis, Br. J. Cancer 119 (8) (2018) 928–936.
5. M. Oliveira, R.C.G.M. Silva, C.A. Cmara, I.A.D. Souza, R.V.S. Amorim, Evaluation of acute toxicity of β-lapachone associated with chitosan as a cytoprotective agent, J. Brasileiro Patol. Med. Lab. 54 (5) (2018).
6. H. Liu, M. Sun, Z. Liu, C. Kong, W. Kong, J. Ye, et al., KRAS-enhanced macropinocytosis and reduced FcRn-mediated recycling sensitize pancreatic cancer to albumin-conjugated drugs, J. Control. Release 296 (2019) 40–53.
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0168365922004527


