近日,清华大学药学院陈立功课题组及其合作者以“Hepatic mitochondrial NAD+ transporter SLC25A47 activates AMPKα mediating lipid metabolism and tumorigenesis”为题在《肝脏学》(Hepatology)杂志在线发表研究论文,该研究报道了肝脏特异性线粒体载体蛋白SLC25A47通过激活AMPKα介导脂质代谢稳态,其表达缺陷参与了非酒精性脂肪肝和肝细胞癌等疾病的发生与发展。
研究背景
非酒精性脂肪肝病(NAFLD)是目前被公认的在全世界范围内最普遍的慢性肝病,给世界公共卫生事业带来了沉重的负担。SLC转运蛋白广泛表达在人体的各种组织中,其成员众多,广泛分布在细胞膜和各类细胞器膜上,在各个组织中充当着“代谢门控”的角色,全基因组关联分析发现SLC转运蛋白在人类疾病中起着至关重要的作用,其表达具有组织特异性,有望成为治疗代谢性等疾病的新靶点。
研究结果
二甲双胍可以通过增加细胞能量传感器AMPKα的活性改善临床前动物模型的NAFLD。本研究发现二甲双胍影响多种SLC转运蛋白的表达,其中以Slc25a47的变化最为显著(图1A, B)。SLC25A47特异性高度表达在肝脏组织中,但它的转运底物及其在生理代谢调控方面发挥的作用尚待进一步研究。
本研究利用CRISPR/Cas9技术构建了Slc25a47基因敲除(KO)小鼠,发现在蛋氨酸-胆碱缺乏饲料或高脂饲料喂养条件下,Slc25a47基因敲除小鼠表现出更加明显的肝脏脂肪积累。随后,我们构建了ob/ob (Slc25a47-KO)小鼠,发现相比于对照组ob/ob (WT)小鼠,ob/ob (Slc25a47-KO)小鼠肝脏中脂肪积累增加(图1C),血清和肝脏组织中甘油三酯和胆固醇含量增高(图1D)。RNA Seq测序结果显示,相较于ob/ob (WT)小鼠,ob/ob (Slc25a47-KO)小鼠肝脏中多种与脂肪酸和胆固醇合成相关基因的表达增加(图1E)。通过对其机制研究,发现Slc25a47敲除通过抑制AMPKα磷酸化来促进固醇调节元件结合蛋白SREBPs活化,进而调节诸多生脂基因的表达,促进脂肪生成,使ob/ob (Slc25a47-KO)小鼠肝脏中出现更加明显的脂肪积累(图1F)。进一步地,我们利用13C-代谢流分析发现,Slc25a47敲除小鼠肝原代细胞主要利用氨基酸为脂质合成提供能量(图1G)。另外,在小鼠肝脏中过表达Slc25a47则能够通过促进AMPKα磷酸化来抑制SREBPs活化,减缓高脂饮食小鼠肝脏中的脂肪积累(图1H)。
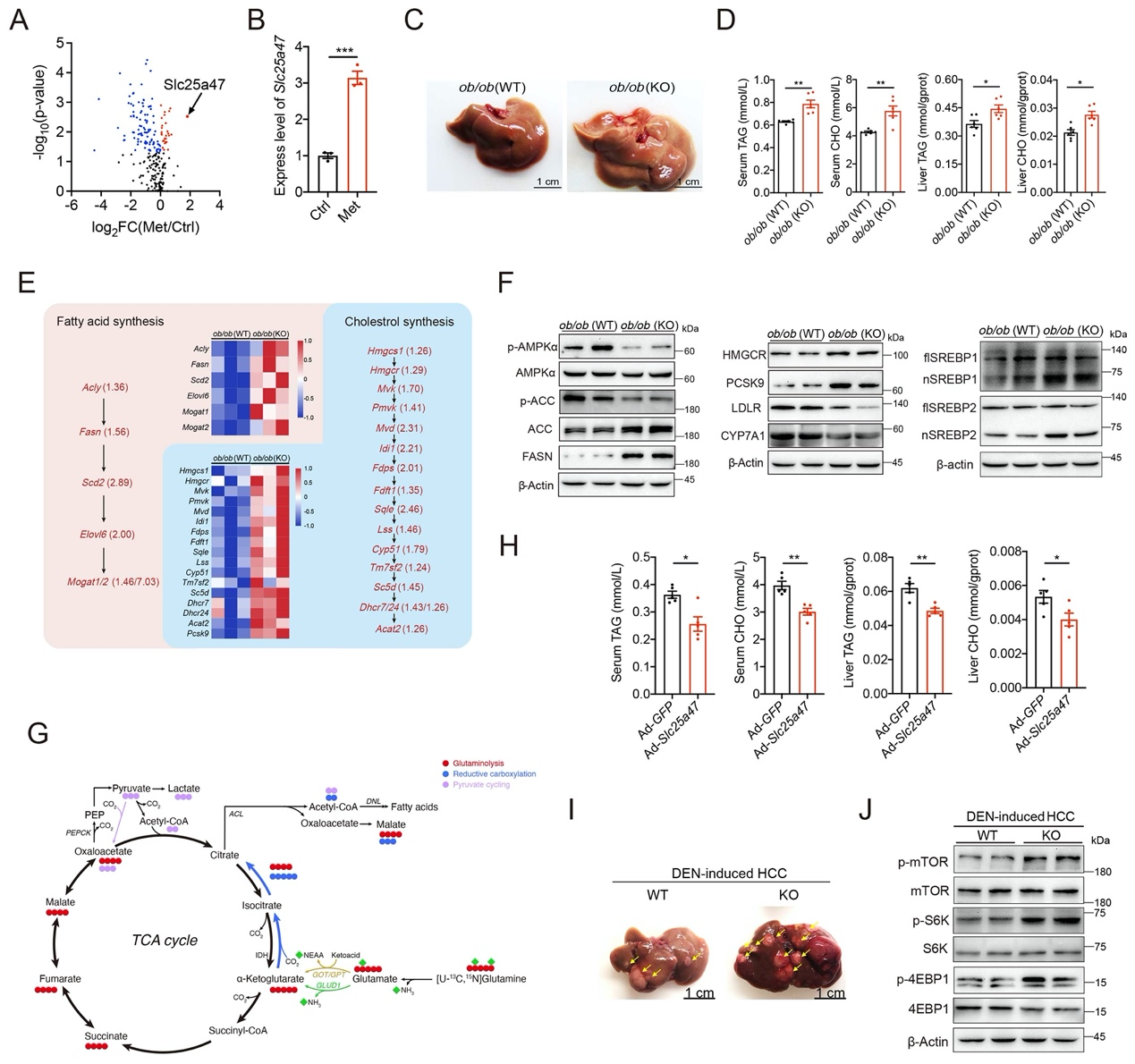
图1 SLC25A47通过激活AMPKα介导脂质代谢稳态
自从上世纪90年代脂肪酸合酶FASN被定义为侵袭性乳腺癌的肿瘤抗原后,越来越多的研究表明脂肪酸的生物合成对于癌细胞的生长和存活是非常重要的。因此,本研究推测SLC25A47参与肝细胞癌(HCC)亦可能与脂代谢相关。有研究显示,利用化学致癌物DEN可以诱导小鼠HCC发生,且其发病过程与人体HCC类似。本研究通过构建DEN诱导的HCC小鼠模型发现,Slc25a47敲除促进了小鼠肝脏脂肪积累,进而促进了HCC的发病进程(图1I, J)。
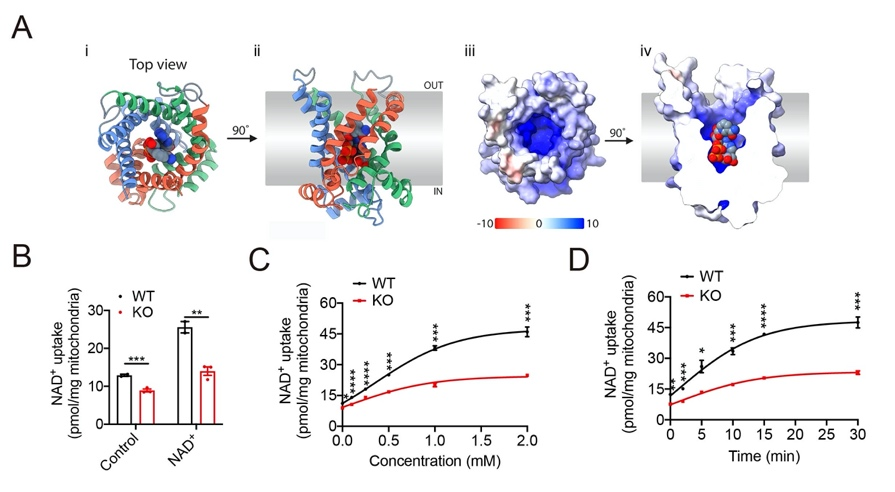
图2 SLC25A47同源性模型及底物验证
此外,根据本研究中的代谢组学测试结果,以及基于AlphaFold2预测并优化的人类SLC25A47的同源性模型对人类代谢组数据库进行的虚拟筛选,获得了一系列底物候选物,包括NAD+、腺苷、FAD、牛磺酸以及多种酰基肉碱、辅酶A、氨基酸等,并通过实验鉴定NAD+为SLC25A47的转运底物之一,SLC25A47通过调节NAD+水平调控SIRT3蛋白活性,以介导AMPKα的激活(图2)。这些发现表明SLC25A47是一种肝脏线粒体NAD+转运蛋白,通过SIRT3-AMPKα-SREBPs途径调节脂质代谢(图3)。总之,该研究为非酒精性脂肪肝和肝细胞癌的临床治疗提供了潜在的药物靶点,为开发针对SLC25A47转运蛋白的药物或基因治疗法提供了更多的研究证据。
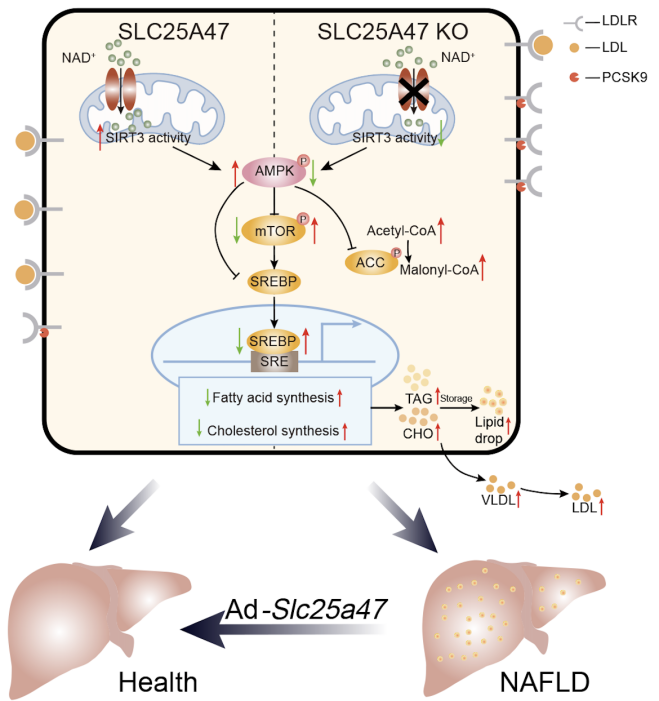
图3 SLC25A47维持肝脏脂质代谢稳态示意图
清华大学药学院陈立功研究员和新加坡科技局A*Star范昊研究员为本文共同通讯作者,清华大学药学院博士后程丽丽为本文第一作者,新加坡科技局A*Star的R.N.V. Krishna Deepak博士和清华大学药学院王国强博士、孟子裔、陶蕾等为本文合作作者。感谢国家自然科学基金委、国家科技部重点研发计划、清华-佛山创新专项基金、清华大学精准医学基金提供的经费支持。


