2024年9月26日,清华大学药学院秦为课题组、北京大学化学与分子工程学院王初课题组和陈兴课题组联合在Angewandte Chemie International Edition杂志上发表了题为 “Chemical recording of pump-specific drug efflux in living cells” 的研究论文。该研究开发了一种化学生物学新技术BRIEF,利用化学探针在活细胞中记录特定外排泵的药物外排过程,为理解药物耐药性提供了新的视角。

研究背景
耐药性在临床药物实践中至关重要,它直接影响治疗效果和患者预后。在细胞膜上存在着大量的外排泵通道蛋白,介导着外源药物的排出。这些外排泵在癌细胞中过表达,造成了很多抗癌药物的耐药性。例如,近年来新兴的蛋白降解靶向嵌合体(PROTAC)也会被外排泵排出,从而降低其胞内浓度和药效,为其临床应用带来了较大挑战。抑制外排泵可以提高对应药物的胞内水平和疗效,因此外排泵抑制剂与抗癌药物联合使用成为一种很有前景的化疗策略。
ATP 结合盒式蛋白(ABC)家族包含多种外排泵,它们介导了多种药物的耐药性。比较常见的如P-糖蛋白(P-gp或ABCB1)会阻碍药物的细胞摄取,或多药耐药蛋白家族(MRPs或ABCC)会外排不同结构特征的多种药物。鉴定某种药物具体由哪些外排泵所排出至关重要,但却充满挑战。主要原因是不同外排泵的底物数量众多且结构迥异,例如MRP1 (ABCC1)可以泵出数百种不同结构的药物,包括抗癌药物长春花碱和重金属阴离子;同时一些药物可能是多个泵的底物,如黄芩苷,它同时由MRP3和MRP4运输。这使得通过结构预测来判断药物是否为特定外排泵的底物十分困难,同时也缺乏高通量筛选手段在活细胞中鉴定可被特定外排泵排出的小分子药物。
研究内容
针对以上问题,本文开发了一种生物正交报告抑制外排(bioorthogonal reporter inhibiting efflux,BRIEF)系统,用于评估活细胞中具有泵特异性的药物外排。BRIEF中使用的生物正交外排探针(BEP)包含三个关键要素(图1a):
(i) 靶向特定外排泵的特异性底物支架,保障BEP的外排泵选择性
(ii) 对细胞内蛋白质进行共价标记的反应元件
(iii) 可通过点击化学进行荧光检测的检测元件
在BRIEF实验中,如果待检测药物和BEP通过了相同外排泵,会产生竞争效应导致BEP外排减少,从而增加BEP的胞内浓度及其蛋白质标记强度(图1b)。通过对细胞裂解物进行点击化学反应偶联荧光基团,可通过胶内荧光检测判断细胞内BEP水平(图1c)。基于此,BRIEF技术将瞬时动态的外排过程记录为稳定、可累积的化学标记信号,便于后续检测。
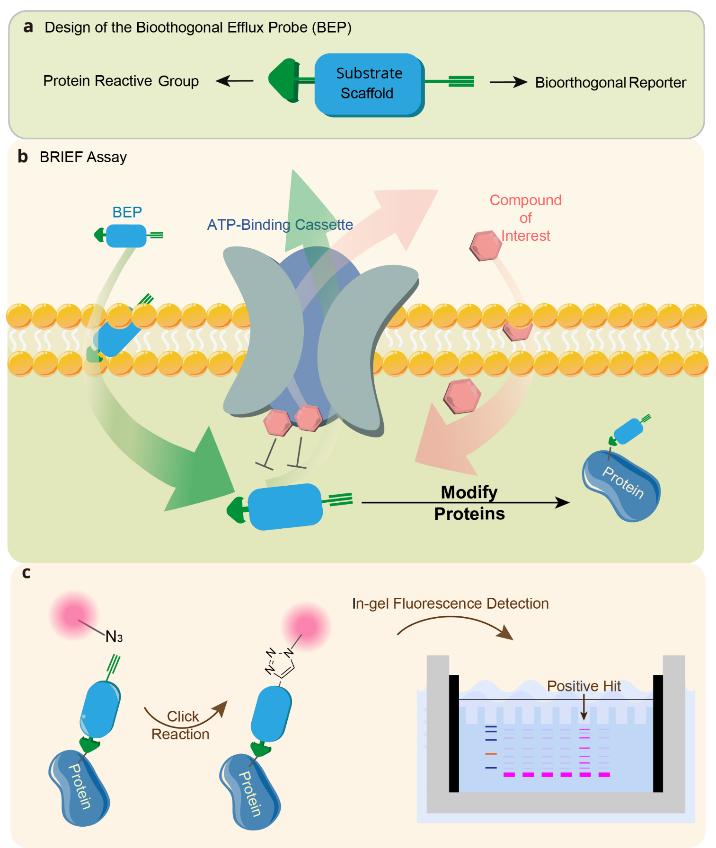
图1. BRIEF的工作原理
为了验证BRIEF的可行性,首先需要发展特异的BEP探针。作者首先关注到了全乙酰化非天然糖探针(如Ac4GlcNAl),这类探针被广泛应用于糖质代谢标记研究糖基化的生物学功能。乙酰化保护显著提高了非天然糖探针的疏水性和细胞膜通透性,但近年来也发现乙酰化保护造成了非天然糖探针与半胱氨酸的副反应。由于此类疏水探针可能是外排泵的潜在底物,同时又具有特异的胞内蛋白反应活性,作者首先探究了全乙酰化非天然糖探针成为BEP的潜力。以Ac4GlcNAl探针为例,作者利用不同泵的抑制剂共处理细胞,发现ABCC家族的抑制剂MK-571显著提高了Ac4GlcNAl的标记信号(图2a)。这表明Ac4GlcNAl主要通过ABCC亚家族排出,因此作者分别敲低了ABCC的不同外排泵,发现了负责其外排的外排泵为ABCC3,4,10和12,因此Ac4GlcNAl可以作为这些外排泵的BEP探针。作者随后选择了此类外排泵的已知底物黄芩苷来测试其对Ac4GlcNAl的外排竞争效果。结果显示在不同的细胞系中,黄芩苷处理都会增加Ac4GlcNAl的标记强度(图2b)。作者随后筛选了其它黄酮类化合物,作者发现槲皮素、芹菜素和黄芩素也都是潜在的ABCC底物(图2c)。

图2. 基于非天然糖探针的BRIEF策略验证
作者进一步基于BRIEF建立小分子药物的外排筛选平台,对409种天然产物的外排情况进行了筛选鉴定(图3a), 从而发现了单宁酸、没食子酸和胆固醇这三种天然小分子可以由ABCC外排泵所排出(图3b)。其中单宁酸对Ac4GlcNAl标记信号的提高最为明显,因此作者进一步验证了ABCC的抑制剂是否可以增强单宁酸的药用活性。单宁酸已知具有抑制癌细胞增值和抗SARS-COV-2的活性,作者发现结合ABCC抑制剂MK-571处理,可以显著提高单宁酸的抑癌活性(图3c)和抗SARS-COV-2的活性(图3d)。
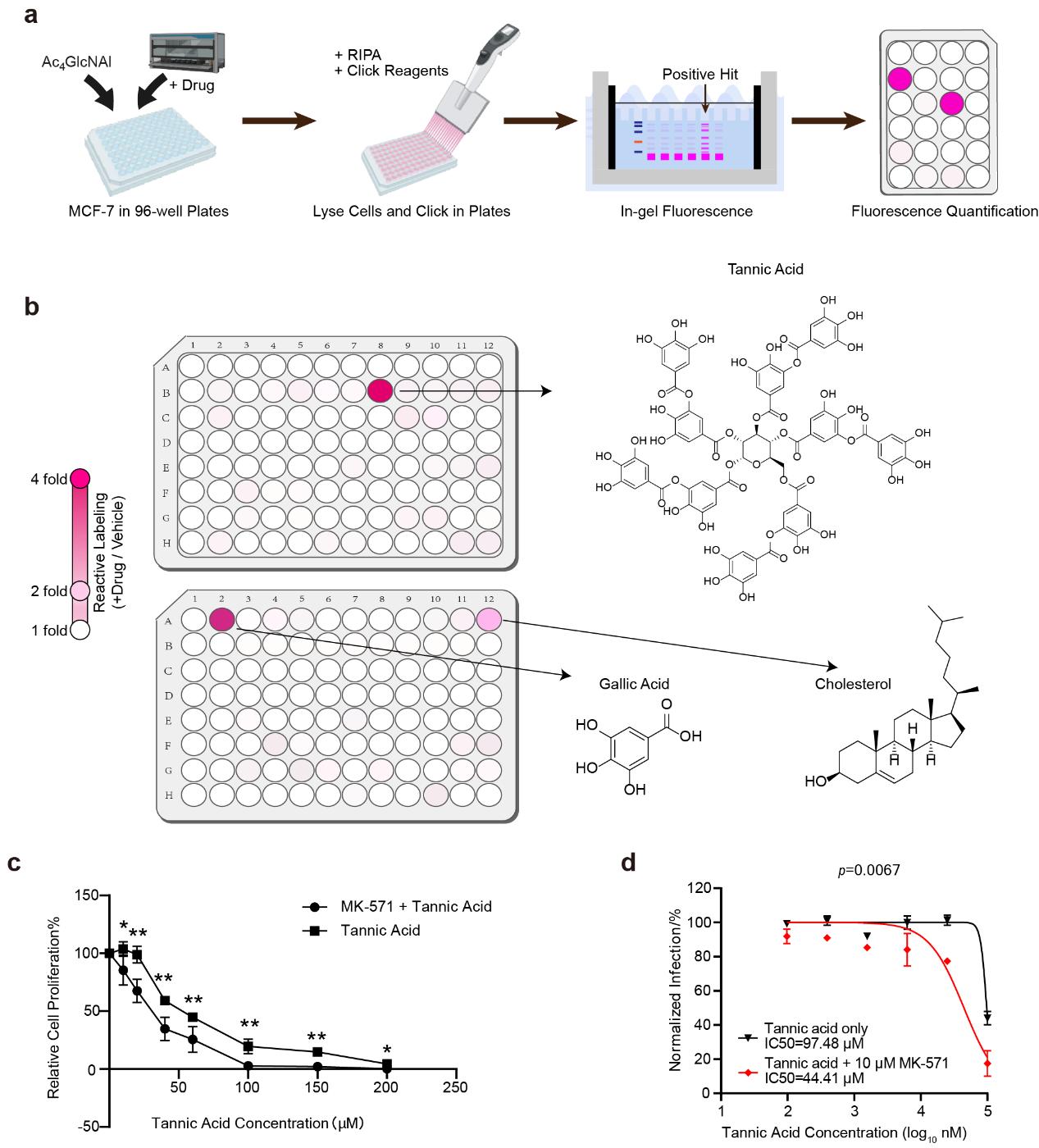
图3. ABCC外排泵的药物外排筛选
作者最后验证了BRIEF策略的普适性,发展了针对P-gp(ABCB1)外排泵的BEP探针。罗丹明123已知可以被ABCB1外排,同时它具有光催化邻近标记的反应活性。作者因此选用罗丹明123作为ABCB1的BEP探针(图4),并同样进行了活细胞内的底物筛选,发现了二氢茉莉酸甲酯作为新的P-gp底物,证明了BRIEF策略的普适性。综上所述,BRIEF方法提供了一个通用的、可扩展的活细胞筛选平台,通过对细胞内蛋白质的化学标记来监测药物外排情况。

图4. 基于光催化邻近标记的BRIEF策略检测P-糖蛋白介导的药物外排
致谢
清华大学药学院秦为助理教授、北京大学化学与分子工程学院王初教授、北京大学化学与分子工程学院陈兴教授为本文的共同通讯作者。清华大学基础医学院丁强副教授为本文提供了重要实验帮助。清华大学药学院博士生孙雪歌、北京大学博士毕业生陈影(现为中国医学科学院药用植物研究所助理教授)为本文的共同第一作者。清华大学博士生杨晨,博士后潘宣圳,北京大学博士毕业生杨嵩,林玮(现为加州大学圣迭戈分校博士后),全柏峄(现为加州理工大学Staff Scientist)为本文提供了重要实验帮助。清华大学刘刚课题组提供了细胞系和小分子药物支持。清华大学药学院活性筛选平台提供了筛选技术支持。秦为课题组得到了国家高层次海外人才计划,国家自然科学基金面上项目,清华-北大生命科学联合中心,清华大学笃实计划,北京生物结构前沿研究中心,北京分子科学国家实验室基础研究基金等基金支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202409282


