2025年2月22日,清华大学药学院钱锋课题组在《Journal of Controlled Release》杂志发表了题为“Albumin-Conjugated Flumethasone for Targeting and Normalization of Pancreatic Stellate Cells”的研究论文。该研究报道了氟米松作为一种高效去活化胰腺星状细胞(PSC)的候选药物,并提供了基于白蛋白的靶向PSC药物递送手段,为实现针对PSC的胰腺癌治疗策略提供了新的思路。
肿瘤微环境是导致胰腺导管腺癌预后不佳的关键因素,活化的PSC驱动肿瘤微环境内复杂的相互作用,导致对化疗耐药和免疫耐受微环境的形成,从而促进肿瘤的生长。因此,如何调节PSC的去活化对胰腺癌的治疗至关重要。在本研究中,研究团队试图回答靶向去活化PSC中“递送什么药物”和“如何实现递送”这两个关键问题。
首先,该研究利用转录组学工具建立了一套多维度评估方法,用于定量比较多个潜在候选化合物的PSC去活化能力。通过对PSC表型和功能影响的综合评估,氟米松在细胞水平和动物模型中均表现出高效的PSC去活化作用。进一步研究表明,氟米松通过PSC去活化从而重塑肿瘤微环境,并且能够调控PSC的蛋白分泌以及与肿瘤细胞的相互作用。
此外,本研究发现活化的PSC表现出增强的白蛋白内吞作用,基于此现象提出了白蛋白结合药物可以作为靶向PSC的药物递送策略。研究设计了白蛋白与氟米松的化学偶联物并验证了其能够维持PSC去活化的功能,白蛋白偶联氟米松显著改善了肿瘤微环境,从而协同增强了吉西他滨在KPC小鼠胰腺肿瘤模型中的抗肿瘤效果。
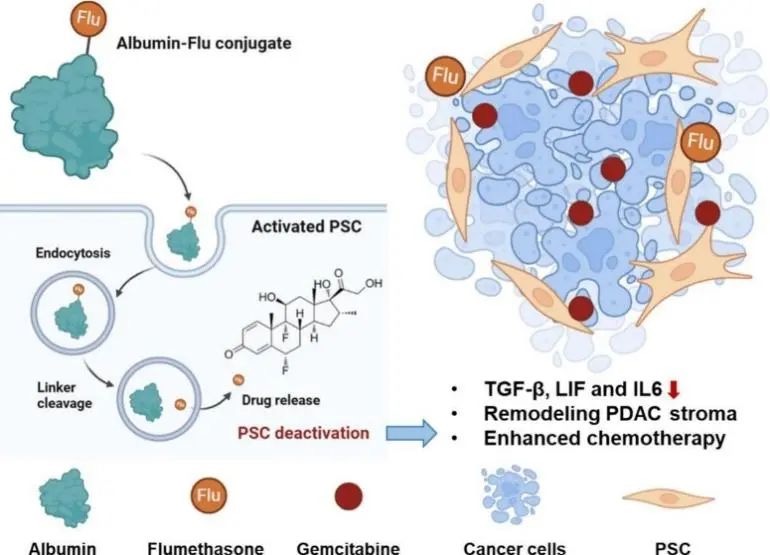
白蛋白偶联氟米松去活化PSC并重塑肿瘤微环境
本研究通过对氟米松去活化PSC的功能和机制研究表明了其对肿瘤微环境的调节作用,揭示了其在临床肿瘤治疗中的潜在应用价值。此外,与白蛋白的结合改善了氟米松的安全性和靶向性,为PSC靶向药物在胰腺癌治疗中的应用提供了新的途径。未来,研究团队还将深入探究氟米松的药理作用机制以及白蛋白的胞内转运途径,以深入理解白蛋白偶联氟米松的PSC靶向作用机制。
清华大学药学院钱锋教授为本论文的通讯作者。药学院2021级博士生王开新、2017级已毕业博士生孙梦楠(现北京大学深圳研究生院博士后)为论文的共同第一作者。课题组成员刘诗雨、王睿、刘慧琴等也为该研究做出了重要贡献。该研究得到了国家自然科学基金(82073769)和北京生物结构前沿研究中心的资助。
论文链接:https://www.sciencedirect.com/science/article/pii/S0168365925001579?via%3Dihub=


