最新科研速递
2025年7月31日,清华大学药学院秦为课题组在美国化学会期刊ACS central science上发表了题为“Precise and in vivo-compatible spatial proteomics via bioluminescence-triggered photocatalytic proximity labeling”的文章。该研究开发了一种基于生物发光共振能量转移(BRET)的新型邻近标记技术,该方法有精准的标记半径,并兼具活体环境的适用性。

细胞内蛋白质之间的相互作用构成了维系生命活动的基本网络。这些蛋白质常以稳定或动态的方式组装于特定的亚细胞区域,形成具有功能特异性的“亚细胞社群”,共同参与细胞的代谢、信号转导、应激响应等多种关键过程。以哺乳动物细胞为例,细胞内部高度区室化,不同蛋白在空间上呈现动态分布。例如,在应激颗粒(stress granules, SGs)等无膜细胞器中,大量蛋白可被招募进入,并根据其结合亲和力和动力学行为被划分为“核心”与“外壳”蛋白,构成凝聚体结构。这些复杂的亚细胞结构对蛋白质功能的实现和调控具有重要意义。
空间蛋白质组学被Nature methods杂志评选为2024年的年度技术,邻近标记(Proximity Labeling, PL)技术在空间蛋白质组学中显示出独特优势。其中,光催化邻近标记通过外源光照激活光催化剂触发标记反应,具有很高的时间分辨率,为捕捉快速、动态的蛋白互作事件提供了全新路径。该技术通常将HaloTag与靶蛋白融合,通过HaloTag连接光催化剂,从而实现遗传编码的靶蛋白邻近标记解析。然而,外源光照除了可以激活HaloTag上偶联的光催化剂,同样也会激活细胞里游离的光催化剂,包括FMN(黄素单核苷酸)等内源光敏小分子,从而带来较高的非特异标记。同时,可见光照射也会带来较大的细胞毒性,影响正常生理功能。更为重要的是,可见光的组织穿透力较差,因此限制了光催化邻近标记在活体动物中的应用。因此,亟需开发低背景、低毒性和活体兼容的光催化邻近标记技术,推动其在活体生物学体系中的时空蛋白质组学应用。
为克服以上挑战,秦为课题组开发了新型光催化邻近标记技术——BRET-ID(图1),该技术利用荧光素酶NanoLuc在细胞内产生生物源光,并通过生物发光共振能量转移(BRET)效应激活相邻遗传编码的光催化剂,而游离的光敏小分子则因为距离效应无法被激活,克服了其带来的非特异标记和毒性问题。同时,NanoLuc及其底物furimazine已经被证明在活体成像中具有广泛应用性,它取代外源光照后也将赋予光催化邻近标记以活体兼容性。
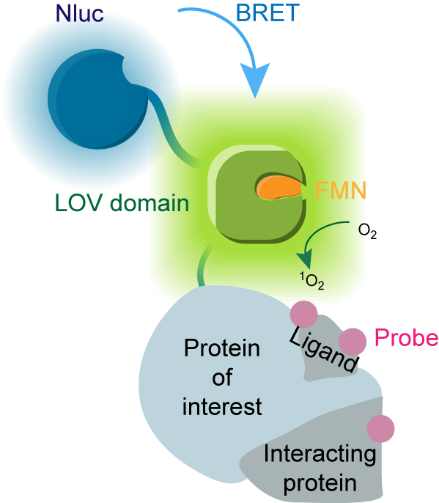
图1. BRET-ID示意图
团队首先利用BRET-ID技术对内质网膜(ERM)进行空间蛋白质组学分析,证明了其高空间特异性与低标记背景。相比于蓝光激活的光催化标记,BRET-ID在无空间对照的条件下即可实现精准标记,显著减少细胞质非特异性蛋白的假阳性,避免内源光敏剂诱导的广泛背景信号。BRET-ID富集的蛋白更集中于ERM及其相关膜结构,而蓝光标记方法中富集的蛋白则大多数是胞质蛋白(图2)。
图3.(A)BRET-ID标记示意图,用于在DAMGO诱导的内吞作用期间绘制hMOR相互作用蛋白 (B)BRET-ID鉴定到的hMOR相互作用蛋白的PLA验证 (C)BRET-ID标记示意图,用于SG蛋白组的绘制 (D)BRET-ID鉴定到的压力条件下SG蛋白图谱 (E)成像验证鉴定得到的蛋白与SG的共定位
为了验证BRET-ID的活体兼容性,我们在小鼠肿瘤模型中进行了标记实验,首次描绘了G3BP1在活体环境下的互作图谱。共鉴定出268个显著富集蛋白,涵盖多个相分离能力强的RNA结合蛋白,显示出与体外数据的显著差异,强调了体内邻近标记对解析病理状态下蛋白网络的独特价值。同时,NanoLuc的生物发光适用于活体成像,因此BRET-ID具备实现在活体动物中靶蛋白的同时成像和标记。
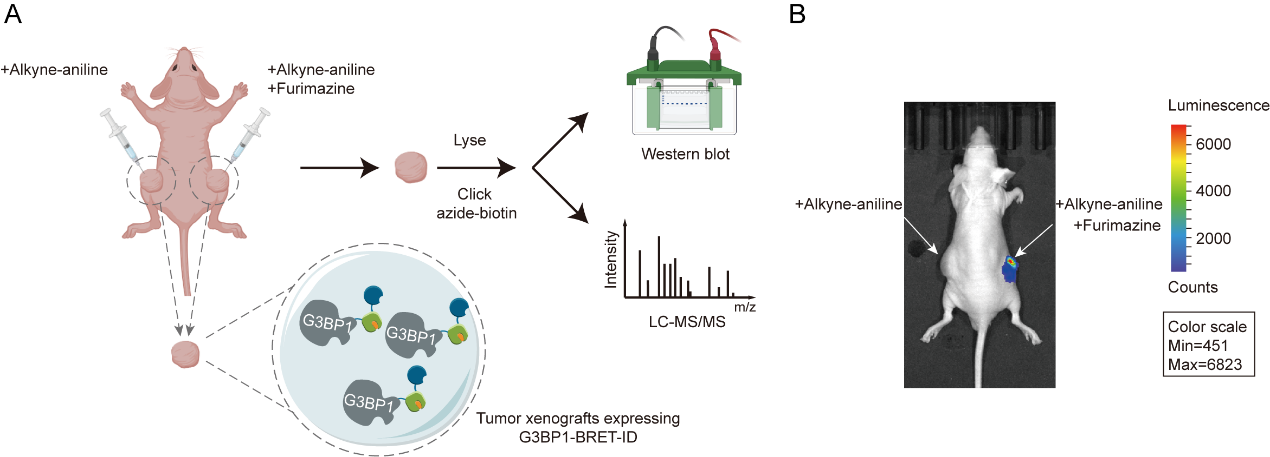
图4.(A)BRET-ID标记示意图,用于绘制体内G3BP1的相互作用蛋白 (B)小动物荧光成像显示BRET-ID在体内保持活性
论文链接https://pubs.acs.org/doi/10.1021/acscentsci.5c00520?sessionid=


