2025年8月11日,清华大学药学院陈立功团队与南方科技大学闫凯歌团队合作,在《自然通讯》(Nature Communications)杂志在线发表了题为 “Molecular basis of human taurine transporter uptake and inhibition”的研究论文。该项研究通过冷冻电镜技术解析了人牛磺酸转运蛋白(TauT)的 11 种不同构象结构,系统揭示了牛磺酸的识别、转运及抑制剂作用的分子机制,为理解相关生理过程和疾病机制提供了关键结构基础。

牛磺酸作为哺乳动物体内条件性必需的微量营养素和含量丰富的氨基酸,广泛分布于脑、视网膜、心脏、肾脏和肝脏等多种组织中,在神经发育、视网膜保护、免疫调节、代谢稳态维持等多种生理过程中发挥关键作用。TauT作为牛磺酸跨膜转运的关键蛋白,其功能异常与男性不育、视网膜病变及胃癌、结直肠癌等多种癌症的发生发展密切相关。然而,人源TauT的底物特异性、底物转运机制以及抑制剂识别机制的阐释尚不全面,限制了相关药物的开发。深入研究TauT的结构与功能,对理解其底物识别、转运及抑制剂作用的分子机制,阐明相关疾病的发病机制具有重要意义。
该研究团队成功解析了TauT结合不同底物或底物类似物的高分辨率冷冻电镜结构(图1),揭示了TauT与这些小分子底物的具体结合模式。与底物牛磺酸或底物类似物β-丙氨酸结合时,TauT被捕获为闭塞构象,而底物类似物胍基乙酸和γ-氨基丁酸将TauT稳定在中间态构象。通过结构研究和功能分析,发现TauT通过其中心结合腔(由TMs 1,3,6和8围绕)与牛磺酸及其类似物特异性结合,腔内的关键残基如Gly62和Tyr138在同家族成员中高度保守,并确定了Leu134和Glu406两个关键氨基酸残基在TauT底物特异性中的核心作用,为理解GABA转运蛋白亚家族的底物选择性提供了新视角。
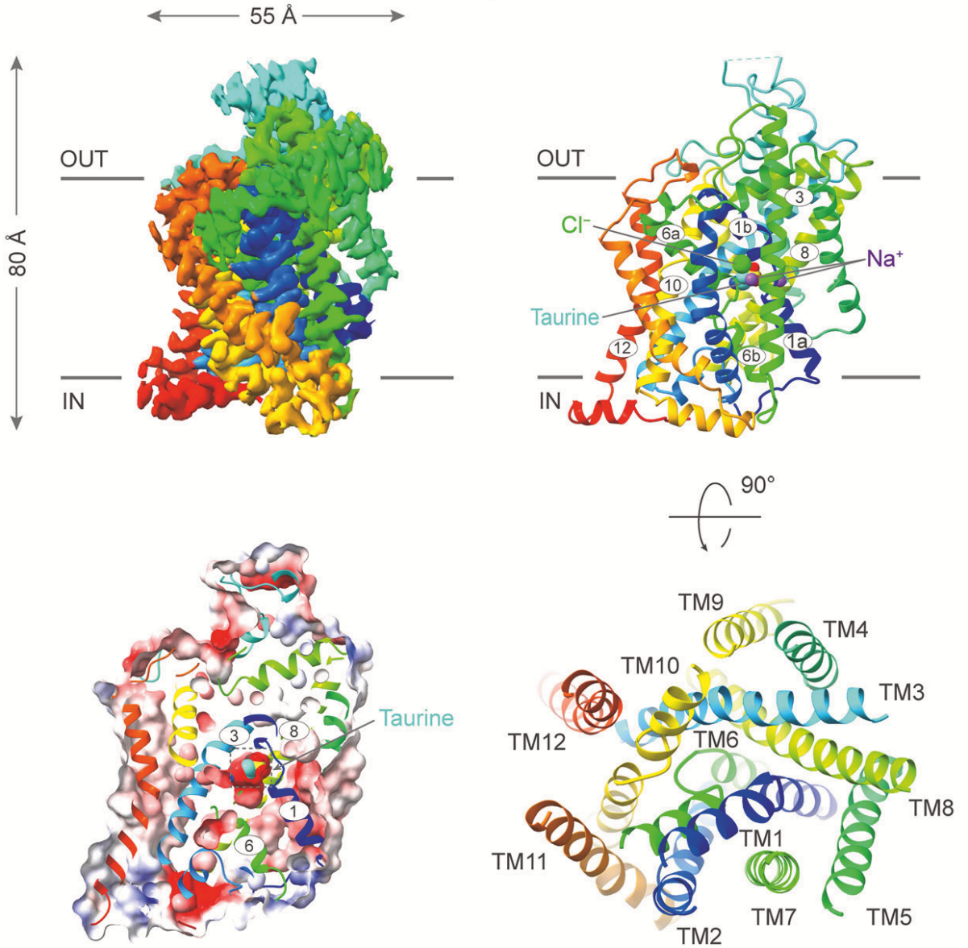
图1 人源TauT冷冻电镜结构
此外,该研究团队还解析了 6 种 TauT 抑制剂(哌啶甲酸、咪唑-4-乙酸、哌啶-4-磺酸、胍基乙基磺酸、5-氨基戊酸和高牛磺酸)的作用机制,发现它们通过两种策略阻断牛磺酸转运(图2)。这些发现揭示了TauT抑制剂的分子作用模式,为设计高选择性 TauT 抑制剂提供了结构基础,尤其对癌症等相关疾病的药物研发具有重要参考价值。
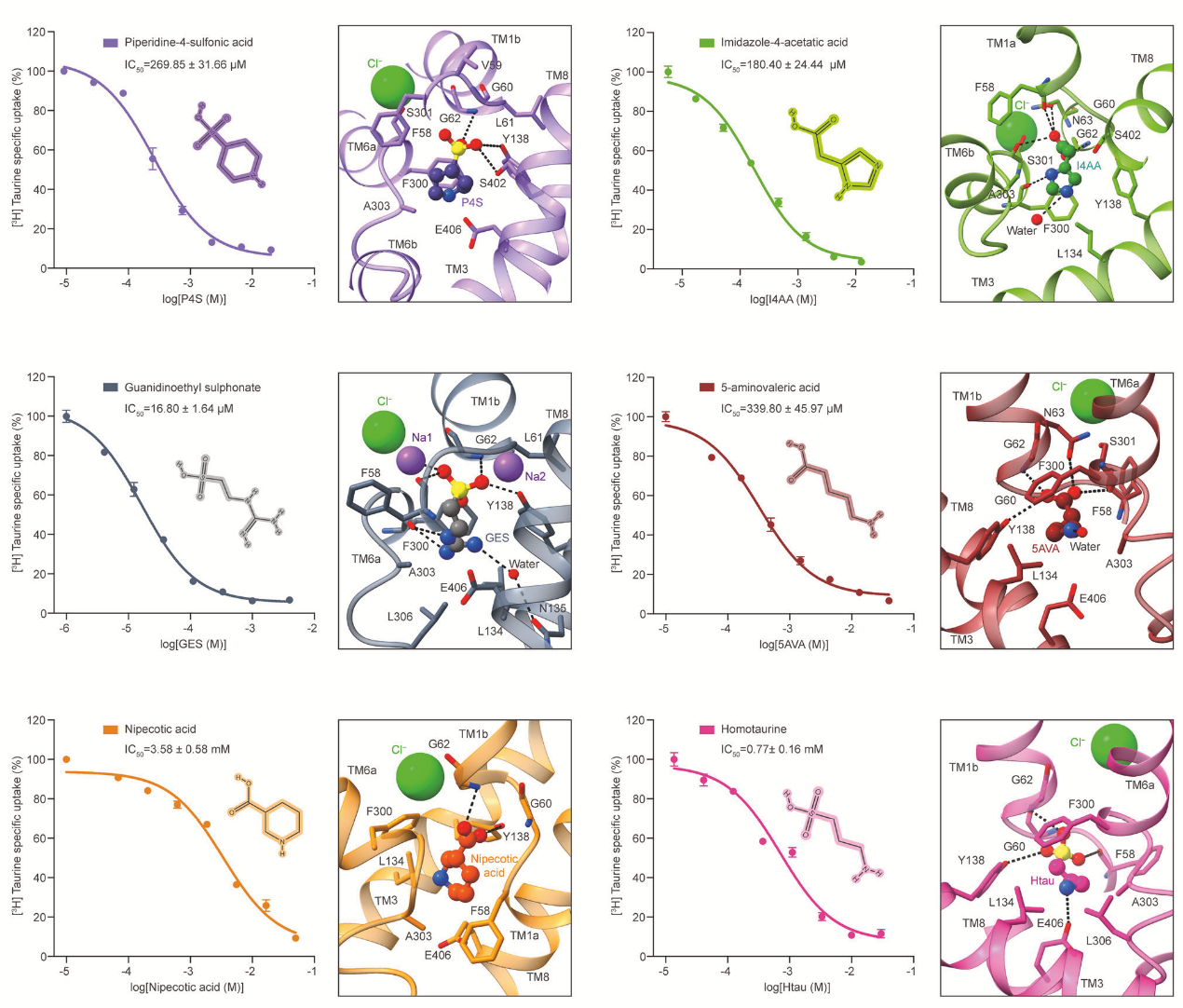
图2 6种TauT抑制剂对牛磺酸转运的抑制作用机制
综上所述,本研究深入揭示了TauT的底物识别、转运及抑制剂作用的分子机制(图3),为理解GABA亚家族转运蛋白的功能提供了重要参考。基于这些精细结构,有望推动针对TauT的药物设计,为治疗与TauT相关的癌症、神经退行性疾病等提供新的靶点和思路。
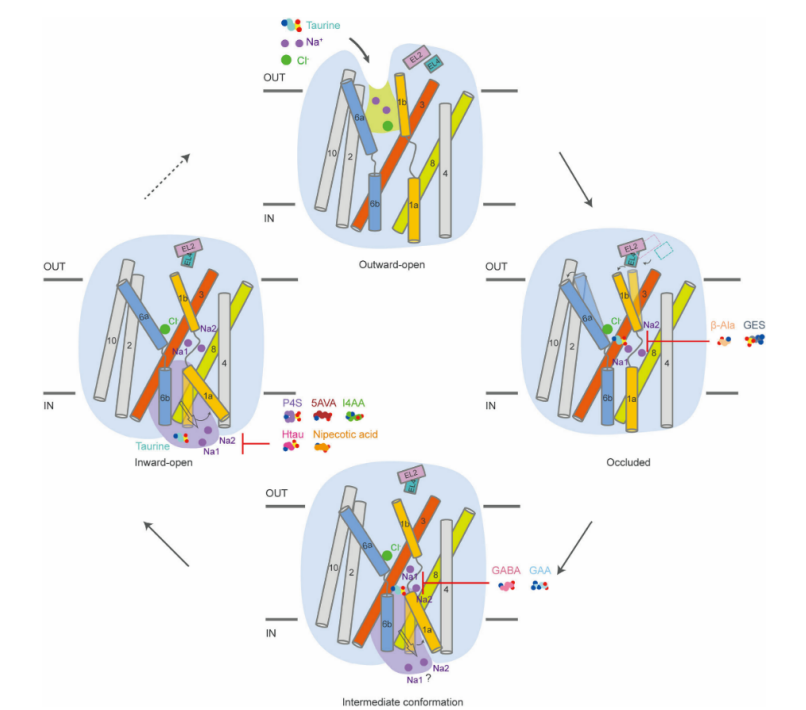
图3 TauT底物转运及抑制机制示意图
南方科技大学闫凯歌教授和清华大学药学院陈立功教授为本文共同通讯作者。南方科技大学博士研究生杜博文、清华大学药学院程丽丽博士后(已出站,现为北京清华长庚医院助理研究员)和南方科技大学硕士研究生谢嘉英为本论文的共同第一作者。该论文得到国家自然科学基金和科技部国家重点研发计划等基金资助。
论文链接https://www.nature.com/articles/s41467-025-62857-w?sessionid=


