在天然免疫细胞中,环状 GMP-AMP 合成酶(cGAS)是关键的胞质 DNA 传感器,能够识别微生物来源或异常的自身双链 DNA(dsDNA)。cGAS 被激活后可催化合成环状二核苷酸 2'3'-cGAMP,该分子进一步结合并激活适配蛋白 STING,从而启动 TBK1-IRF3 信号通路并诱导 I 型干扰素应答。近期多项研究表明,大量 cGAS 定位于细胞核并与核小体结合,这种机制可能是用于防止自身 DNA的异常激活。然而,在免疫细胞中维持如此大量核cGAS蛋白的生物学意义仍不清楚,仅靠其物理隔离作用似乎不足以解释其进化保守性。
有趣的是,cGAS 在富含 T 细胞的淋巴组织中普遍表达。在 CD8⁺ T 细胞中,cGAS 可通过 AKT 依赖性机制维持中心记忆 T 细胞表型,从而增强抗肿瘤免疫。尽管 CD4⁺ T 细胞也表达 cGAS,但其 DNA 识别能力却主要依赖 KU 复合物,而非 cGAS,这一点可通过 DNA 刺激无法诱导这些细胞产生 cGAMP 或分泌干扰素-β 来证明。这表明我们对 cGAS 在适应性免疫中,尤其是 CD4⁺ T 细胞生物学中的功能仍缺乏完整理解。
2025年9月16日,清华大学药学院尹航教授团队在Cell 子刊Cell Reports发表了一篇题为“T cell-intrinsic cGAS-CTCF regulation maintains regulatory T cell development and function”的研究论文。该研究揭示了核cGAS在适应性免疫中的STING非依赖性作用,建立了调控调节性T细胞(Treg)介导免疫耐受的cGAS-CTCF轴。在稳态下,cGAS主要位于Treg细胞核内,而在naïve CD4⁺ T细胞受到刺激后,cGAS的转录被激活并转位入核。通过T细胞和Treg特异性cGAS敲除小鼠实验,研究表明cGAS在胸腺阳性选择期间通过TNFRSF共刺激分子促进Treg分化,并稳定FOXP3表达。在细胞和动物层面,cGAS能够维持Treg的免疫抑制功能以及肿瘤免疫耐受。
cGAS 通过维持 TCR 信号传导以促进 Treg 分化
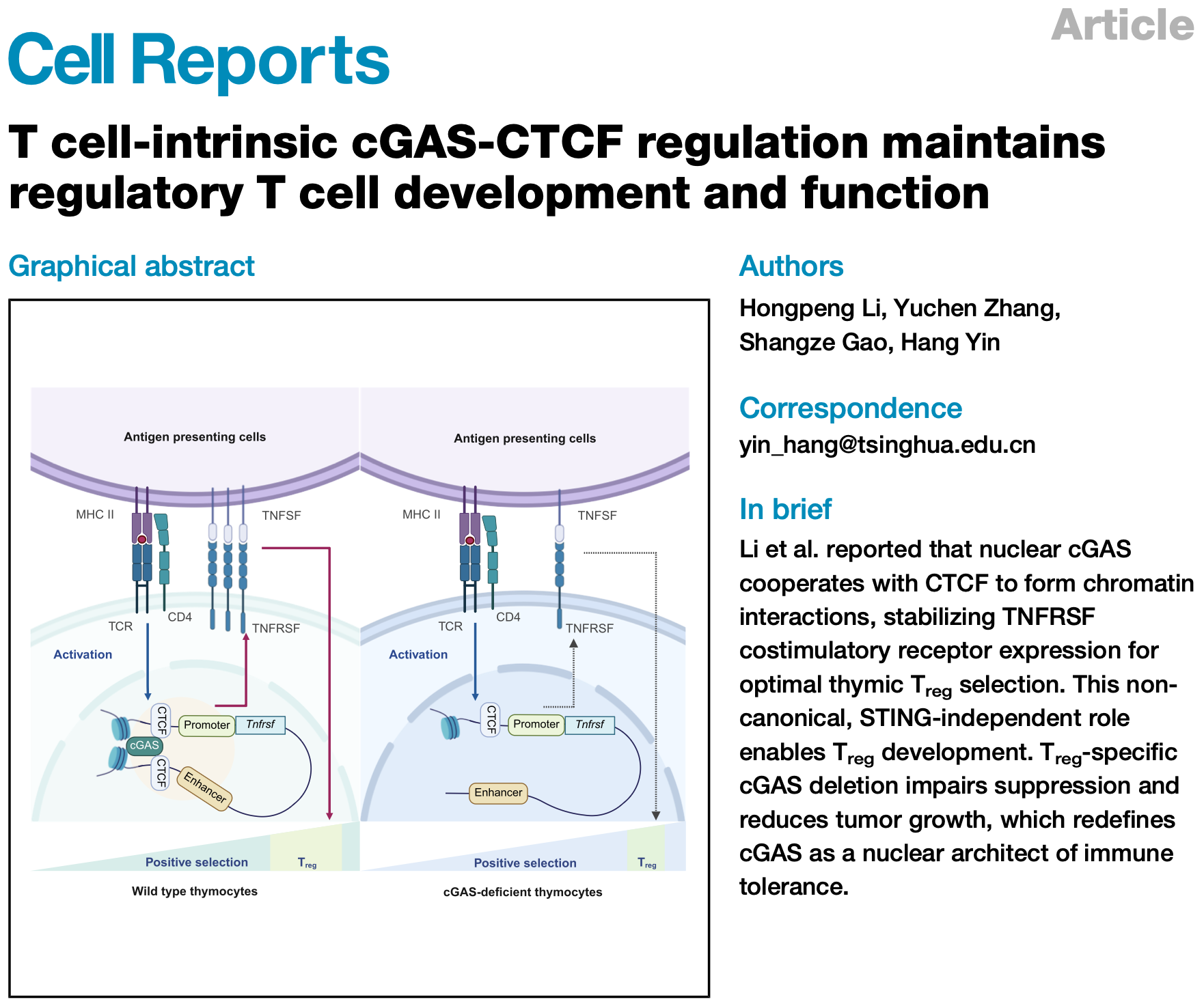
首先,作者通过流式分析发现cGAS敲除鼠的胸腺和脾脏Treg数量和比例明显降低,且在与野生型骨髓的竞争性移植模型中也体现出类似的表型。进一步分析胸腺细胞亚群揭示阳性选择明显受损,而阴性选择不受影响。利用scRNA-seq结合TCR测序对Cd4CreCgasfl/fl与对照小鼠的CD4⁺CCR7⁺胸腺细胞进行转录组分析显示,这些细胞可分为13个亚群,其中Treg前体特征性表达Tnfrsf9(4-1BB)、Tnfrsf4(OX40)及Tnfrsf18(GITR)。在cGAS缺失胸腺细胞中,FOXP3⁺ Treg数量减少,成熟tTreg标志基因Nt5e(CD73)表达下降。同时,TCR信号强度报告基因Nr4a1的转录水平在Treg前体、preTreg及Treg中均显著减弱。TCR谱系分析进一步显示,cGAS缺失胸腺细胞的TCR克隆型复杂度下降,且cGAS缺失Treg群体中TCR克隆呈过度扩增,提示其多样性受损。综上,cGAS通过增强阳性选择中的TCR信号,维持tTreg分化与TCR库多样性。
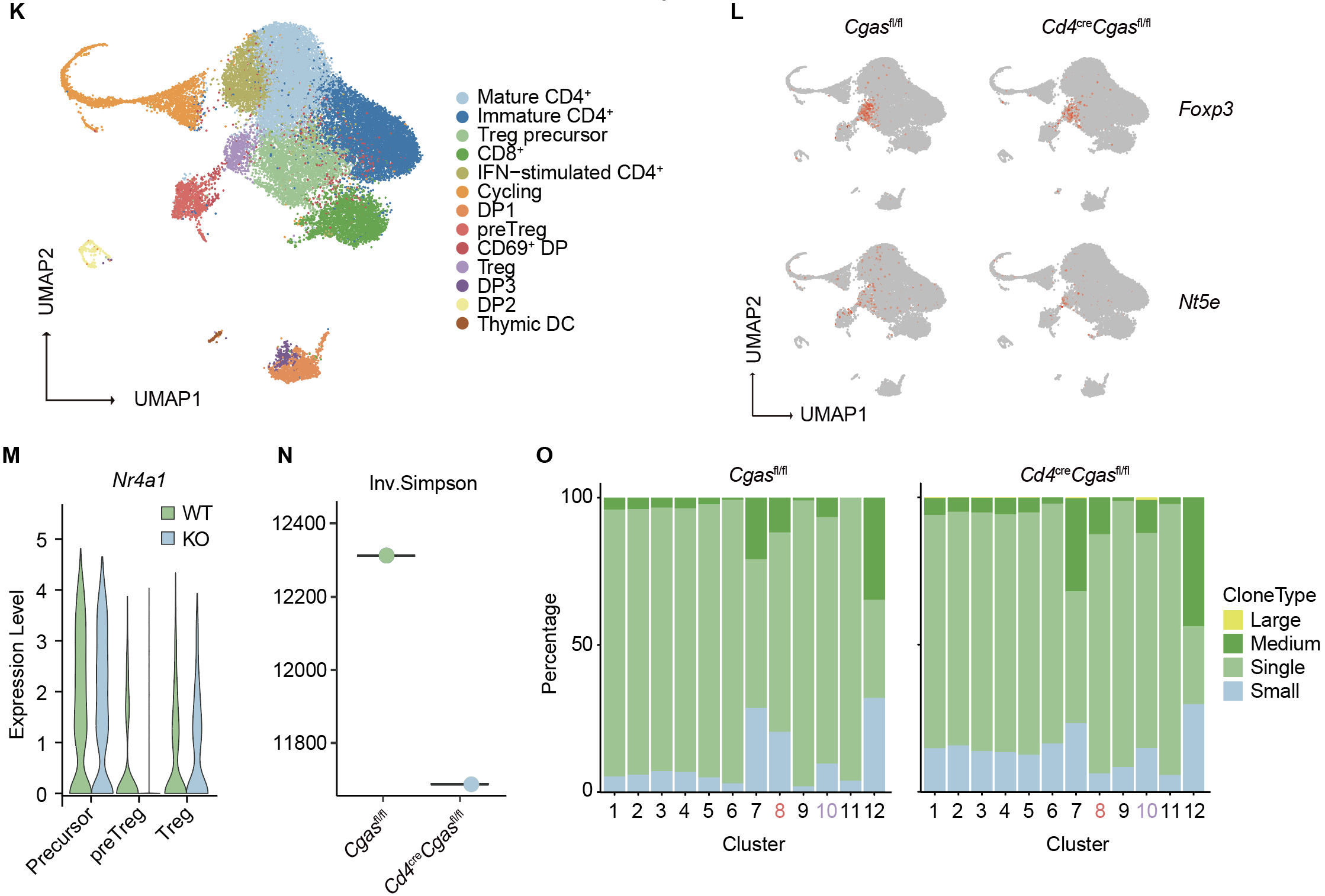
图1. CD4⁺CCR7⁺胸腺细胞的scRNA-seq和TCR-seq分析
TNFRSFs 表达是 cGAS 介导 Treg 发育的关键环节
在胸腺正选择过程中,tTreg 前体依赖高强度 TCR 信号与 CD28 共刺激诱导 c-Rel 表达,从而上调 OX-40、GITR 等 TNFRSF 受体基因。单细胞转录组及流式分析提示,CD69⁺OX-40⁺ 胸腺细胞可作为 DP 阶段的早期 tTreg 前体标志。我们发现,cGAS 缺失并不影响 c-Rel 及 ThPOK、IRF4、Helios 等转录因子表达,说明 CD28 信号仍完整;但 CD69⁺OX-40⁺ 比例及 OX-40 表达在前体阶段即下降,后续 CD25、NRP1、CD73 等成熟标志物亦减少,关键的 CTLA-4 表达亦下调。胸腺选择过程中正向信号总量决定 TCR 亲和力阈值及库的形成,而 TNFRSF 信号竞争对高亲和力克隆偏倚具有决定性作用。作者发现,体内给予 4-1BB(TNFRSF9)激动性抗体可显著增加 CD25⁻FOXP3lo 前体比例,并挽救 cGAS 缺失小鼠的缺陷,同时恢复其 TCR Vβ5⁺ 克隆比例至野生型水平。这些结果表明,cGAS 通过维持 TNFRSF 表达和信号强度,保障 tTreg 的有效选择和 TCR 库的稳态。
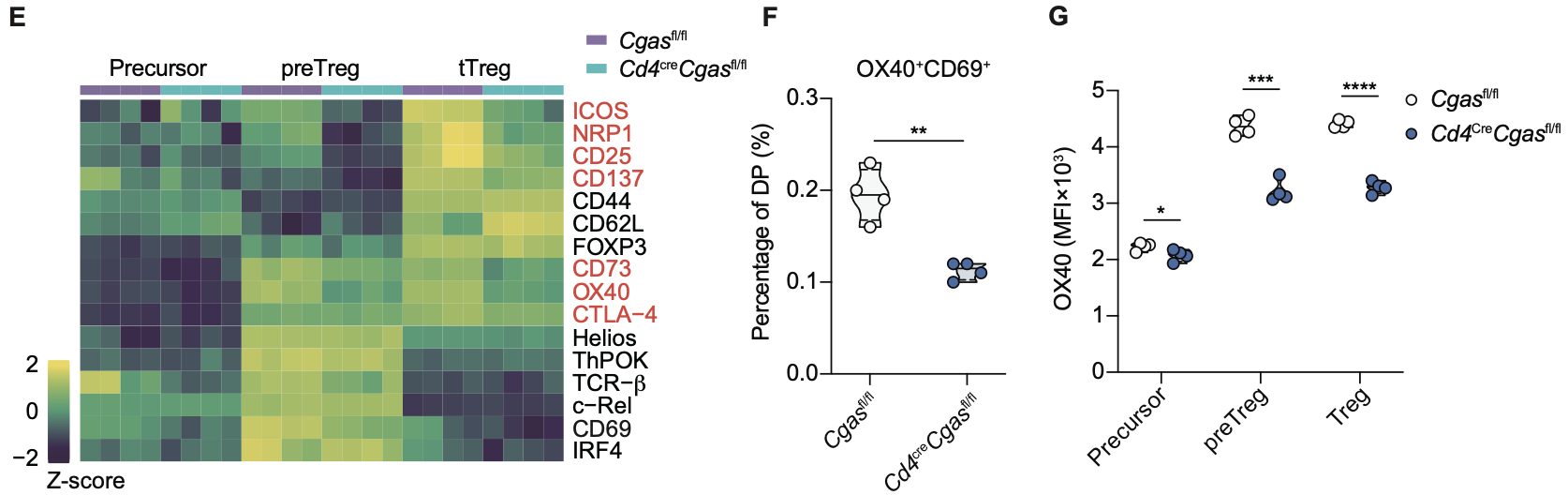
图2. T细胞cGAS条件性敲除tTreg的光谱流式分析
cGAS 协同 CTCF 调控 Treg 的染色质结构
作者使用ATAC-seq揭示了CTCF是cGAS调控tTreg染色质可及性的关键协作因子,并证明了cGAS与CTCF存在内源性相互作用。通过in situ Hi-C和CTCF转录因子CUT&Run差异分析,研究发现cGAS维持了Treg基因组的染色质环结构,且对招募CTCF至Tnfrsf位点起到关键作用。
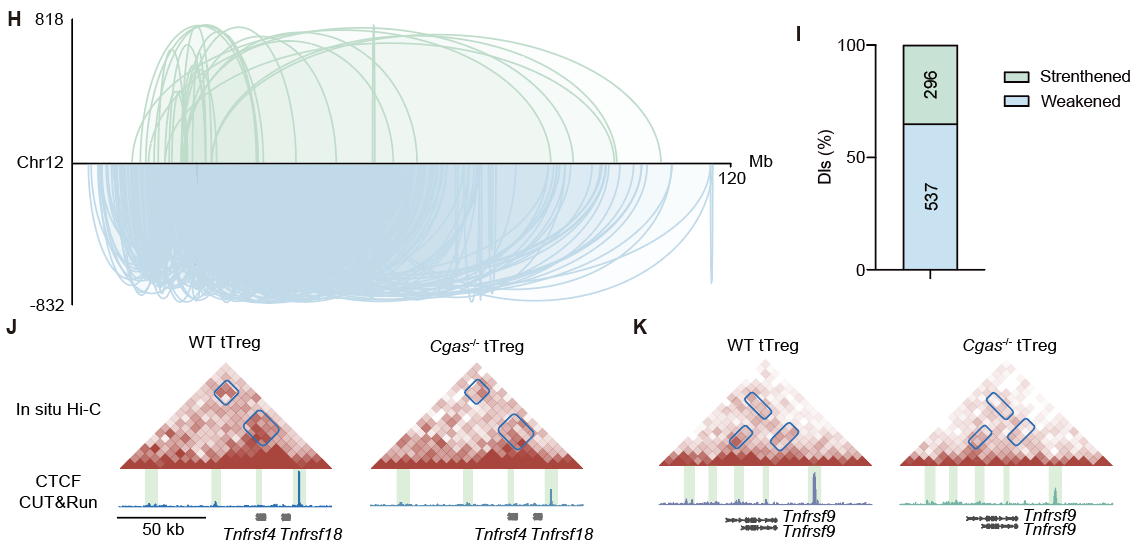
图3. 野生型和cGAS缺失tTreg的in situ Hi-C差异分析
cGAS 对调节性 T 细胞在体内外的抑制功能至关重要
作者通过体外抑制试验证明了Treg的抑制功能依赖于cGAS。在 B16肿瘤模型中,Treg特异性缺失cGAS的小鼠(Foxp3Cre-YFPCgasfl/fl)表现出肿瘤体积和重量显著下降,与Treg稳定性受损的表型一致。单细胞流式分析显示,这些小鼠的肿瘤内Treg比例和数量减少,同时 CD8⁺ T细胞比例增加,且其中耗竭型CD8⁺ T细胞(Tex)减少。这表明,cGAS不仅维持Treg的发育,还在体内外发挥关键的免疫抑制功能。
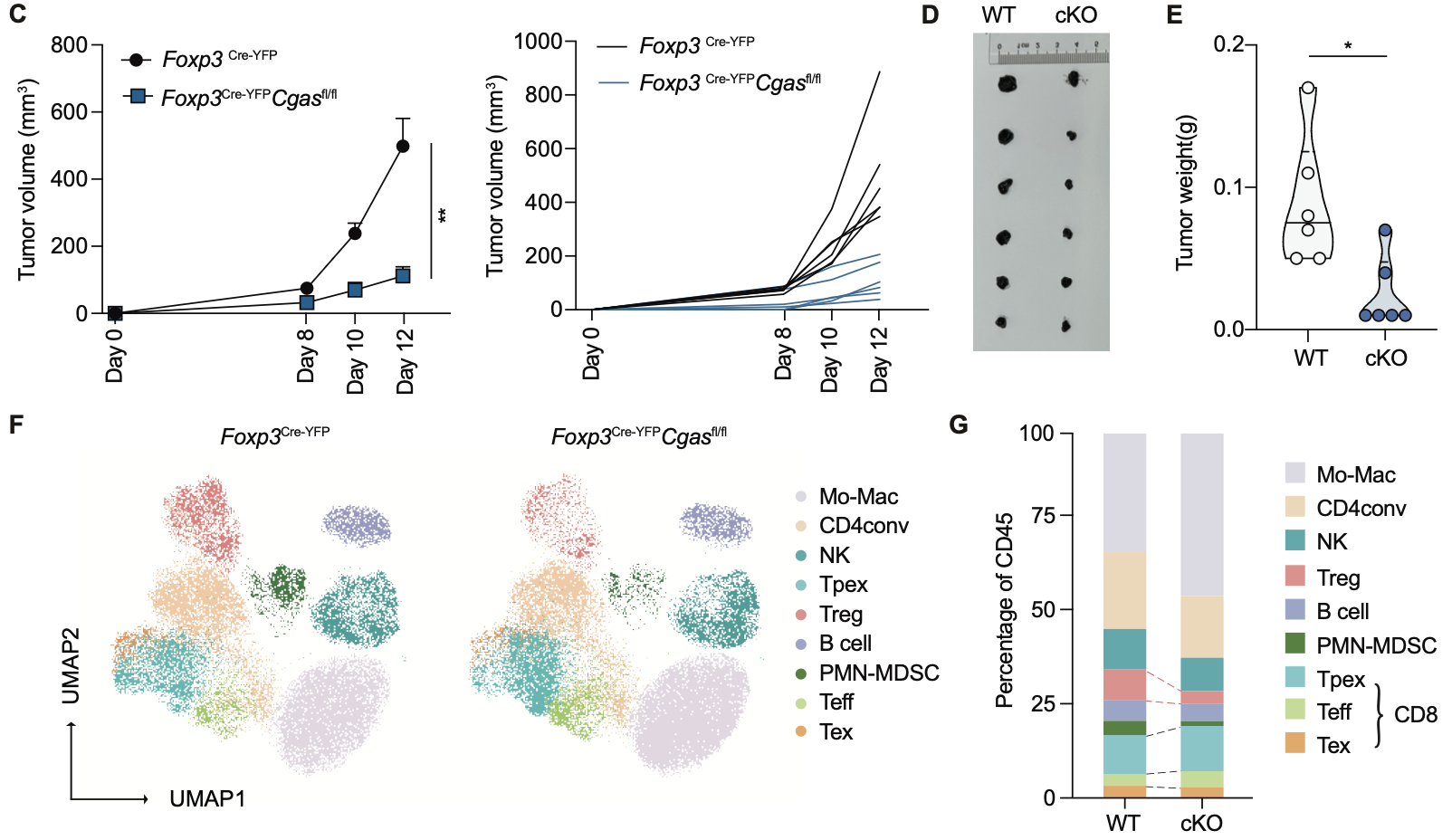
图4. 野生型和Treg条件性cGAS敲除小鼠的B16肿瘤模型分析
综上,本研究揭示了一种cGAS的STING非依赖性的胸腺Treg发育调控机制。cGAS与CTCF协作,通过染色质重塑调控关键共刺激受体TNFRSF9和TNFRSF4的表达。Treg特异性cGAS敲除小鼠的Treg稳定性受损,且黑色素瘤生长显著减弱。这些发现不仅拓展了我们对cGAS在天然免疫范畴以外的认识,也揭示了其在维持免疫耐受中的核内功能。
该论文的第一作者是清华大学医学实验班(MD/PhD)李鸿鹏,通讯作者是清华大学药学院尹航教授。该项研究得到了国家自然科学基金、清华大学学术研究推进计划等项目资助。
完整文章链接:https://www.sciencedirect.com/science/article/pii/S2211124725010733?sessionid=


