2025年10月13日,清华大学药学院尹航教授课题组,在国际权威学术期刊《eLife》在线发表了题为“Organelle membrane-associated proteins recruit cGAS via phase separation to facilitate its membrane localization”的研究论文。该研究首次揭示了细胞内cGAS蛋白在应对DNA刺激时,可以被细胞器膜上发生液-液相分离(liquid-liquidphaseseparation, LLPS)的特定蛋白招募至内质网、高尔基体和内体膜上,从而对其先天免疫活性进行精细空间调控,为理解cGAS-STING信号通路的调节机制提供了全新视角。
天然免疫是机体抵御病原体入侵的第一道防线。当病毒或其他病原体侵入时,其DNA会被细胞内的DNA受体—cGAS(cyclicGMP-AMPsynthase)识别并激活,随后通过合成第二信使cGAMP激活下游STING-TBK1-IRF3信号通路,诱导I型干扰素等抗病毒因子的产生。cGAS的定位和活性受到严格调控,既要及时响应外源DNA,又要避免对自身DNA的错误识别而引发自身免疫疾病。因此,阐明cGAS亚细胞定位和活性调控的机制,一直是先天免疫领域的重要科学问题。
研究团队通过Optiprep密度梯度离心、光电联用显微技术和split-sfGFP互补报告系统等手段,发现DNA刺激后,cGAS不仅存在于细胞质中,还可以被招募至内质网、高尔基体以及内体膜上,并在这些区域形成显著的蛋白凝聚结构。这一现象提示,细胞器膜可能在cGAS的空间定位与活性调控中扮演重要角色。
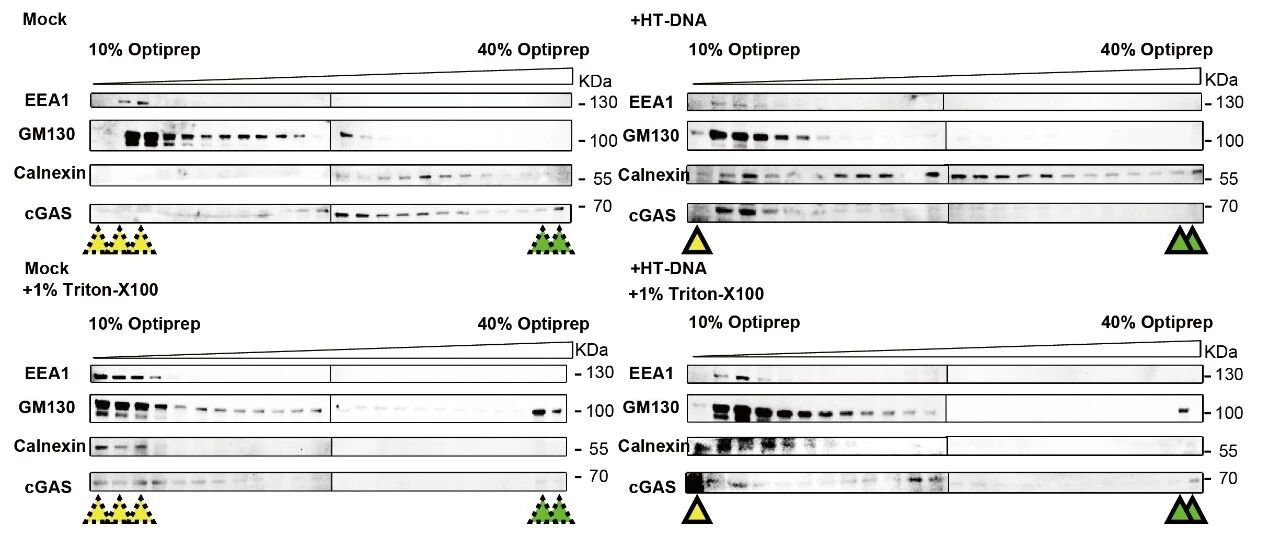
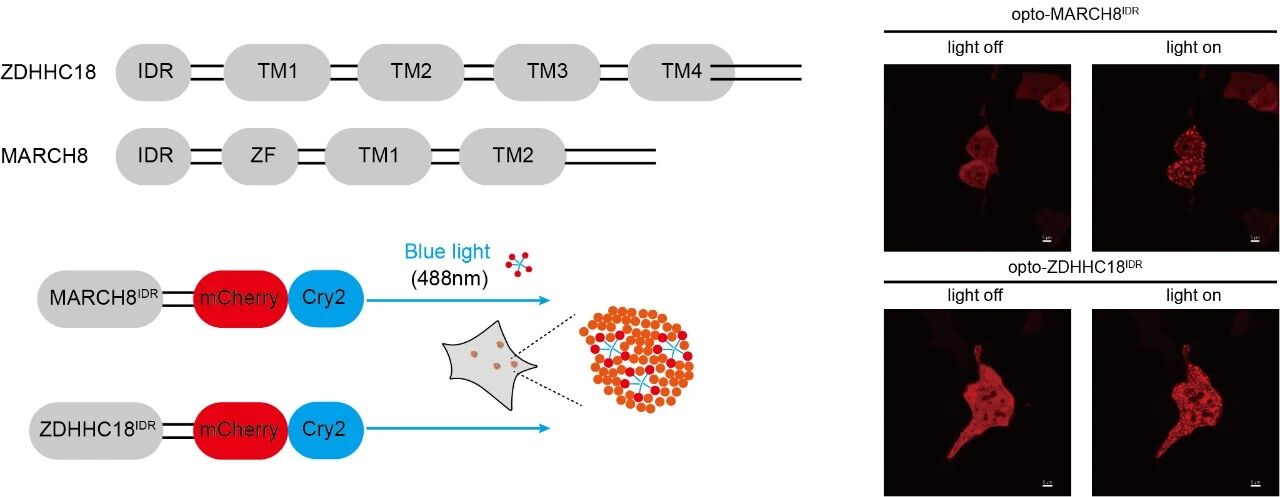
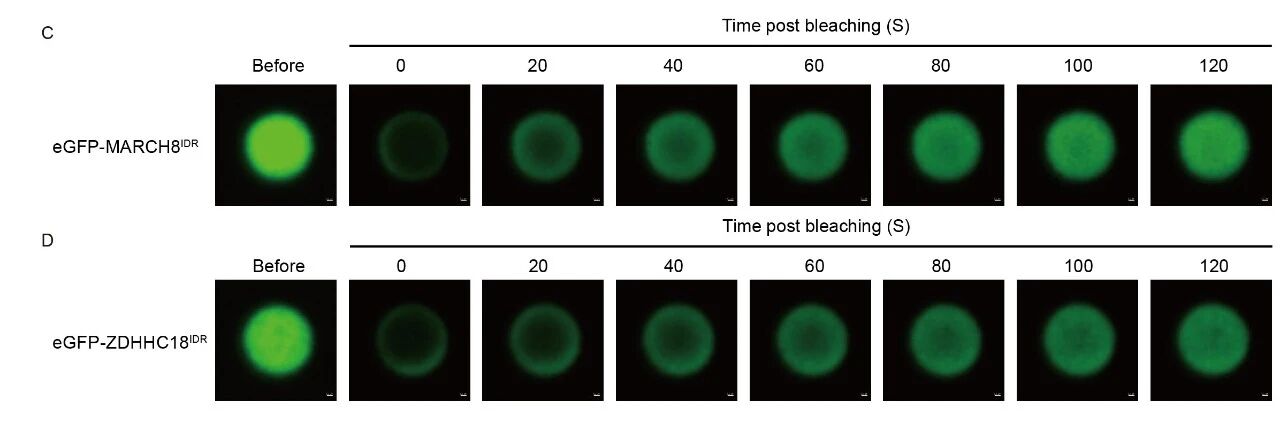
为了探究细胞器膜如何招募cGAS,作者探讨了之前报道的两种分别定位在高尔基体和内体上的膜结合酶—ZDHHC18和MARCH8,并发现这两个细胞器膜结合酶在cGAS的膜定位过程中发挥关键作用。这两种酶的N端含有大量无序序列 (intrinsically disordered regions, IDRs),有助于将cGAS-DNA复合体招募至相应的细胞器膜。作者利用光遗传学系统、原位近邻标记(LOV-turbo)和体外重组蛋白实验系统,证明ZDHHC18和MARCH8的IDR可以在细胞内和体外环境中发生液-液相分离,形成可逆、动态的液滴结构(生物分子凝聚体)。这些凝聚体特异性地招募cGAS及其配体DNA至相应的细胞器膜,实现cGAS的“空间隔离”,并进一步对cGAS进行棕榈酰化和泛素化修饰,最终抑制cGAS的活性、防止过度免疫反应,从而实现对先天免疫信号的精确负调控。
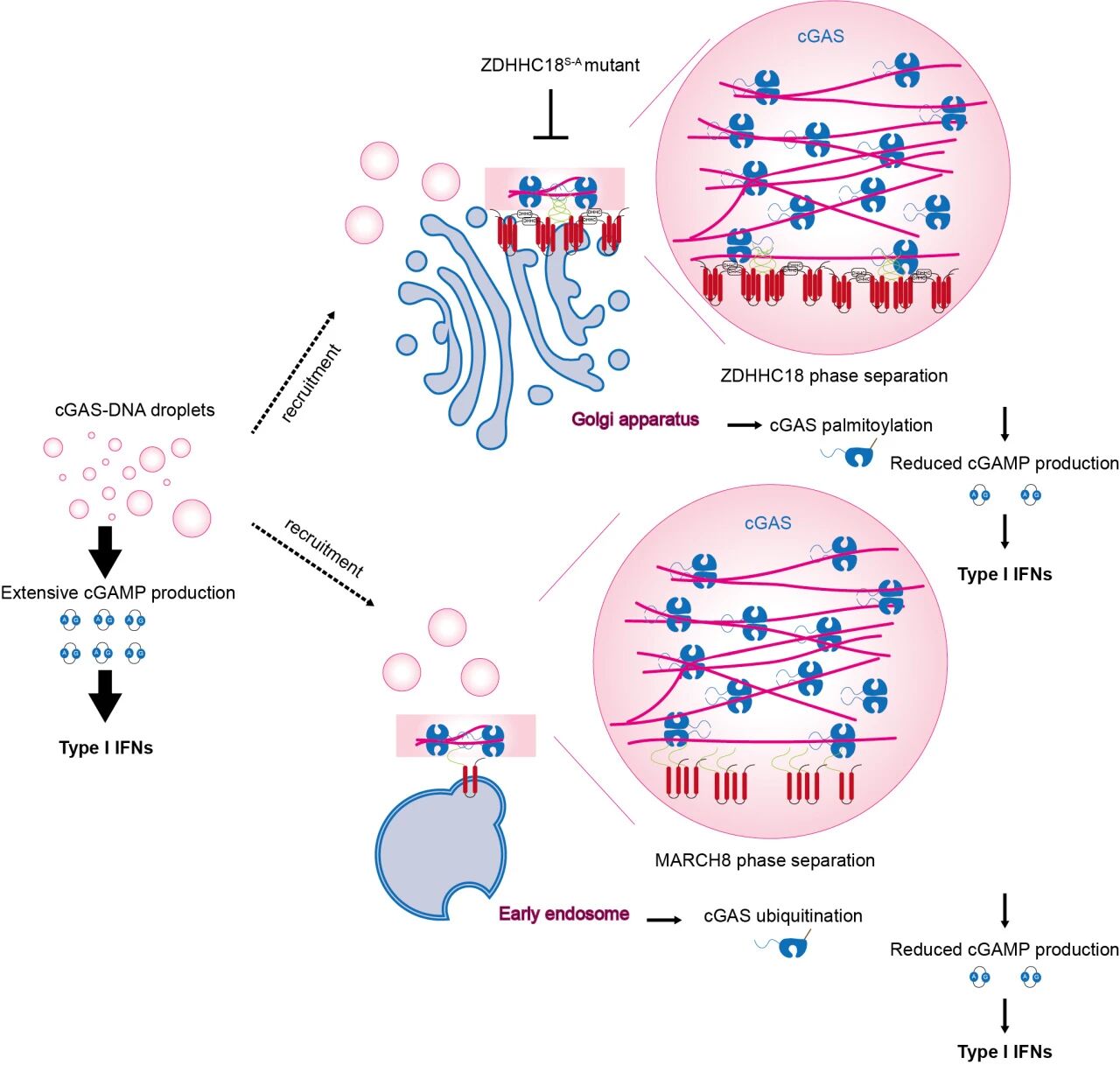
综上,本研究提出了一个全新的调控模型:DNA激活的cGAS-DNA凝聚体可被ZDHHC18和MARCH8在细胞器膜上“捕获”,通过相分离介导的空间定位和翻译后修饰,实现信号强度和持续时间的微调。这一发现拓展了人们对cGAS活性调控的认识,揭示了空间组织、相分离以及翻译后修饰协同调控天然免疫信号的新机制,也为开发靶向cGAS-STING通路的免疫调节药物提供了新的理论基础。
该论文的第一作者施成瑞博士工作单位为南京鼓楼医院。合作作者包括清华大学药学院毕业生苏超飞博士和在读博士生张凯翔,通讯作者为清华大学药学院尹航教授。本研究获得了国家自然科学基金等项目的资助。
阅读全文:https://elifesciences.org/reviewed-preprints/108566v1?sessionid=


