葡萄糖是人体细胞能量的主要来源,而G6P是葡萄糖代谢的“关键枢纽”——它不仅是糖原合成、糖酵解、磷酸戊糖途径等关键代谢通路的起点,更是糖异生和糖原分解的核心中间产物。1947年,格蒂·科里与丈夫卡尔·科里因为发现“糖原的催化转化过程”共同荣获诺贝尔生理学或医学奖。而糖原分解产生的G6P需要进入内质网由葡萄糖-6-磷酸酶催化成葡萄糖,维持葡萄糖代谢稳态,G6PT就是负责完成这一关键转运。G6PT的功能异常会引发GSD-Ib、低血糖、肝肾功能损伤(肝肿大、肾肿大)、生长迟缓、高脂血症等一系列严重疾病。然而,科学界对于G6PT的结构特征、底物识别机制、转运过程及抑制剂作用机制此前并不清楚。
2025年10月24日,清华大学药学院陈立功团队和中国科学院物理研究所姜道华团队合作在Nature Communications杂志发表了题为“ Structural basis for transport and inhibition of the human glucose-6-phosphate transporter G6PT ”的最新研究成果。该研究首次解析了人源葡萄糖-6-磷酸转运蛋白(G6PT)在空载、G6P结合及抑制剂绿原酸(CHA)结合状态下的冷冻电镜结构,揭示了G6P识别和转运的分子机制,以及CHA的抑制机制,为研究相关生理过程和GSD-Ib、低血糖等疾病机制提供了关键结构基础。

研究团队首先对G6PT的功能特性进行了深入研究,发现G6PT与葡萄糖-6-磷酸酶(G6PC1)共表达会显著增加其转运活性,基于这一发现团队创新性地建立了其转运活性测试方法。为了进一步探究其结构基础,研究团队采用ALFA标签融合策略(将短α螺旋标签引入G6PT),结合纳米抗体(NbALFA)辅助冷冻电镜分析,成功解析了G6PT处于外向开放状态(G6PT-apo)、G6PT处于外向开放状态时与G6P复合物(G6PT-G6P)和G6PT与CHA结合后处于内向闭塞状态(G6PT-CHA)的高分辨率冷冻电镜结构。
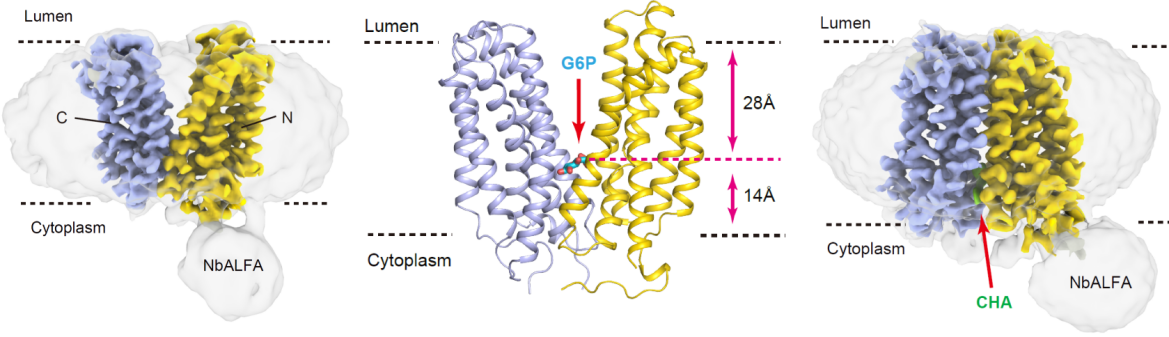
图1 人源G6PT冷冻电镜结构(G6PT-apo,G6PT-G6P,G6PT-CHA)
通过结构分析和定点突变实验,一方面明确了G6P在转运蛋白中的结合位点及关键相互作用残基,发现G6PT识别G6P通过“双亚位点”,亚位点A(磷酸识别区)由TM2上的Y60、K64和TM11上的H366组成,通过极性相互作用精准结合G6P的磷酸基团,亚位点B(葡萄糖识别区)由TM4上的W118、TM5上的W138和S142、TM7上的Y233等残基构成,通过氢键和范德华力固定G6P的葡萄糖部分;另一方面明确了G6PT特异性抑制剂CHA的抑制机制,揭示了其“双重抑制策略”,CHA的奎宁酸部分竞争性占据G6P的结合位点,直接阻断G6P与G6PT的结合,CHA的咖啡酸部分插入TM5与TM10之间,通过π-π堆积和范德华力固定G6PT的“内向闭塞”构象,使其无法转换为转运所需的开放状态,彻底终止G6P转运。通过将GSD-Ib的临床相关致病性突变映射到解出的三维结构上,结合功能突变实验明确了部分突变对蛋白构象、底物结合或转运过程的影响。
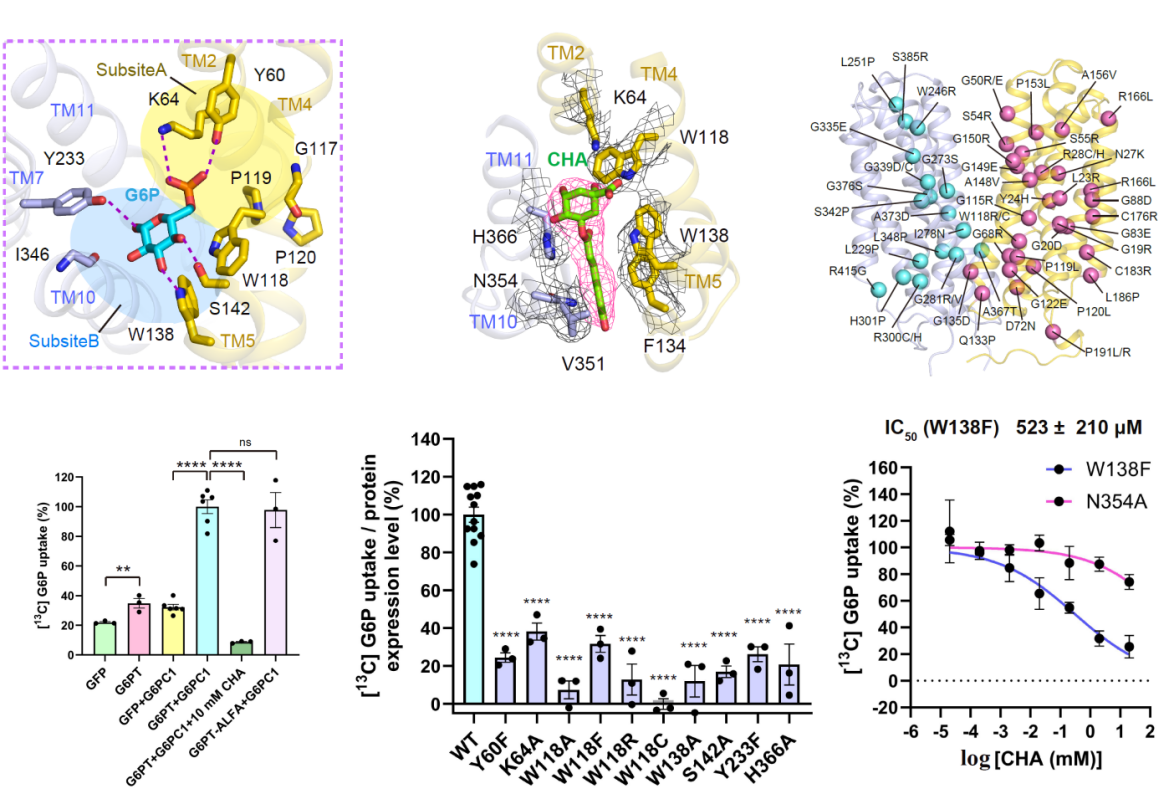
图2 G6PT底物识别、抑制剂结合关键位点及致病突变位点
基于这些研究结果,团队提出了G6PT转运G6P及CHA抑制转运的机制,完善了对其转运过程的理解。
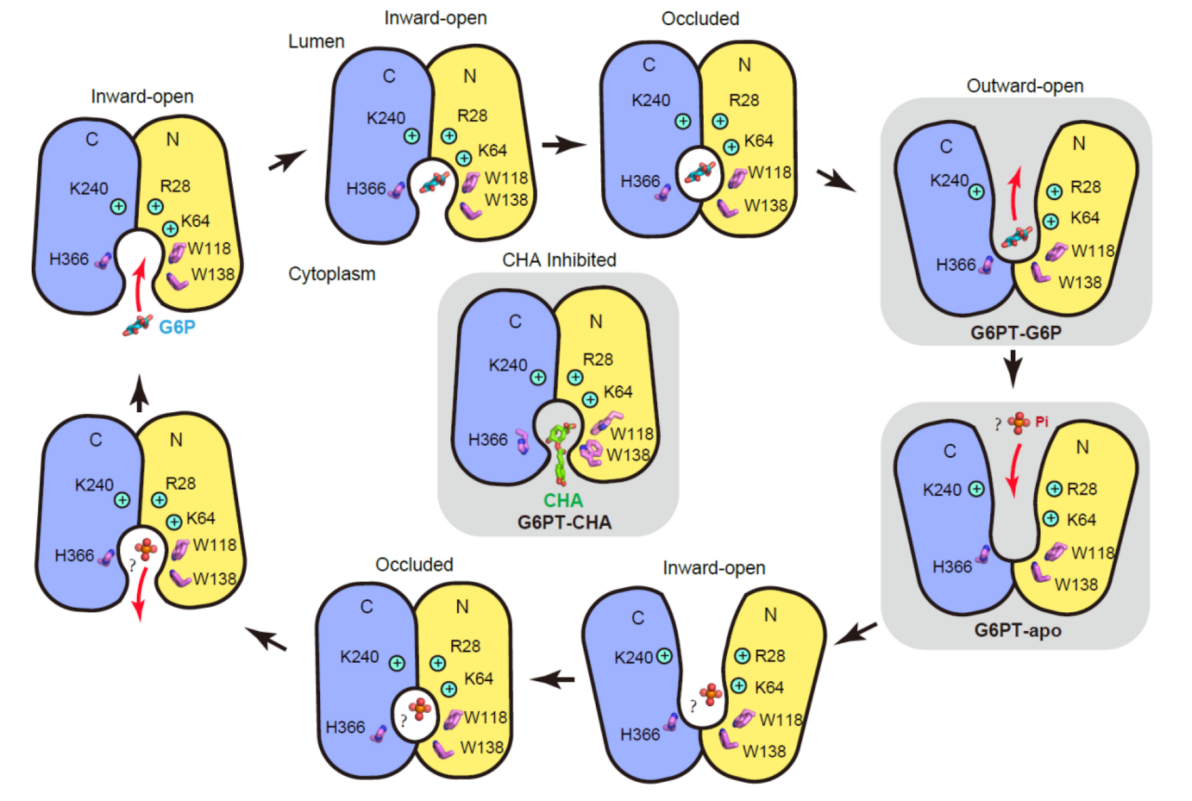
图3 G6PT底物转运及抑制机制示意图
该研究揭示了人源葡萄糖-6-磷酸转运蛋白的结构和转运机制,为深入理解葡萄糖-6-磷酸代谢相关生理过程和疾病发生机制提供了理论依据,还为以G6PT为靶点的药物研发开辟了新的方向,有望为相关疾病的治疗带来新的策略。
中国科学院物理研究所姜道华研究员与清华大学药学院陈立功教授为论文共同通讯作者,中科院物理研究所博士生夏崭忆、清华大学药学院博士生王亚棋、中科院物理所博士后武迪及北京大学现代农业研究院迟程研究员为共同第一作者,清华大学-苏州大学联合培养硕士生李琛为该课题做出重要贡献。该研究得到国家自然科学基金、科技部国家重点研发计划等项目资助,清华大学药学技术中心提供了质谱测试。
阅读原文:https://www.nature.com/articles/s41467-025-64464-1?sessionid=


