
2025年10月31日,清华大学药学院张从刚课题组在Immunity发表了题为Membrane integrity changes upon viral infection activate sphingomyelinase SMPDL3B to restrict cGAS-STING signaling via cGAMP degradation的研究论文。该研究发现SMPDL3B是一种由病毒侵染诱导的cGAMP降解酶,病毒侵染诱导SMPDL3B的稳定和表达,进而抑制cGAS-STING天然免疫反应,有助于病毒的扩增。同时,机制上该研究发现SMPDL3B作为一种GPI锚定的细胞外膜定位蛋白,能够响应各种细胞膜完整性改变的信号,是一种潜在的细胞膜完整性感应器并介导免疫负调控。
宿主和病原体之间存在复杂的“攻防博弈”和“协同进化”,这是所有生命体(植物、动物、甚至细菌与噬菌体之间)与病原体相互作用的永恒主题。其中的核心机制与理论模型一直是生命科学领域研究的热点。例如,“Zig-zag 模型”形象地揭示了植物免疫学中植物与病原体(如细菌、真菌、卵菌、病毒)之间不断升级的免疫攻防过程【1】;而动物的天然免疫系统与病原体之间的相互作用与“军备竞赛”同样完美地体现并验证了该模型的核心思想。在复杂的宿主-病原互作体系中,病原体往往通过多种效应因子(effectors)负向调控宿主的天然免疫反应,而宿主则通过多样的免疫机制抵御病原入侵。
近年来,cGAS-STING天然免疫信号通路被证实是机体感知胞内双链DNA并激活I型干扰素免疫应答的关键通路。该通路的核心组分常受到病原体多种免疫负调控机制的抑制【2】。其中,cGAMP作为cGAS-STING通路的第二信使,能够被病原体分泌的cGAMP降解酶所分解,例如痘病毒的效应蛋白Poxin【3】。在此基础上,领域内提出了一个重要假设:病原体入侵是否会诱导宿主自身产生cGAMP降解酶【2,4】?若这种宿主源性cGAMP降解酶确实存在,一方面可能有助于病原体通过抑制cGAS-STING通路促进其自身复制;另一方面,也可能成为宿主调控免疫反应强度、避免过度炎症的一种自我保护机制。
研究团队首先发现,各种常见的病毒(包括HSV-1,PRV,VACV,VSV,SeV等DNA病毒和RNA病毒)都能够诱导鞘磷脂磷酸二酯酶酸性样蛋白 3B(SMPDL3B)在各种不同细胞和小鼠中的稳定和表达;同时研究团队发现,各种常见的靶向细胞膜的转染试剂(比如PEI和Lipofectamine)和脂质体(比如LNG)同样能够诱导SMPDL3B的表达和积累。SMPDL3B是一种GPI锚定的膜定位蛋白(同样的TLR4通路中的CD14也是一种GPI蛋白),它能够通过内吞途径被降解,从而维持非常低的蛋白表达。在此基础上,研究团队通过系统的实验结果,提示SMPDL3B作为一种此前研究较少的GPI 锚定蛋白,可感知病毒入侵时和膜扰动时的细胞膜完整性变化,进而被稳定表达发挥作用。
研究团队进一步证明,功能层面,DNA病毒诱导的 SMPDL3B可促进病毒感染;而在体外实验和小鼠模型中,SMPDL3B缺失均会抑制病毒增殖。此外,SMPDL3B能抑制DNA病毒诱导的cGAS-STING信号通路及下游天然免疫应答。机制上,研究团队证实SMPDL3B具备cGAMP水解酶活性,病毒通过诱导SMPDL3B表达减弱cGAS-STING信号,进而增强自身感染。结构与功能分析进一步表明,cGAMP诱导的 SMPDL3B二聚化是其水解酶活性的关键。与此一致,破坏二聚化的突变体可显著降低 SMPDL3B水解cGAMP的能力。后续功能实验证实,SMPDL3B在体外和体内均可高效降解 cGAMP。单纯疱疹病毒(HSV-1)感染后,SMPDL3B缺失会导致cGAMP积累增加,并放大cGAS-STING信号,进而降低病毒的增殖。综上,该研究揭示了SMPDL3B是一种响应膜完整性的宿主cGAMP水解酶。该研究揭示了一种新型病毒免疫逃逸策略,同时阐明了通过 SMPDL3B 介导的cGAMP水解来调控cGAS-STING信号的负向调节机制(见模型图)。
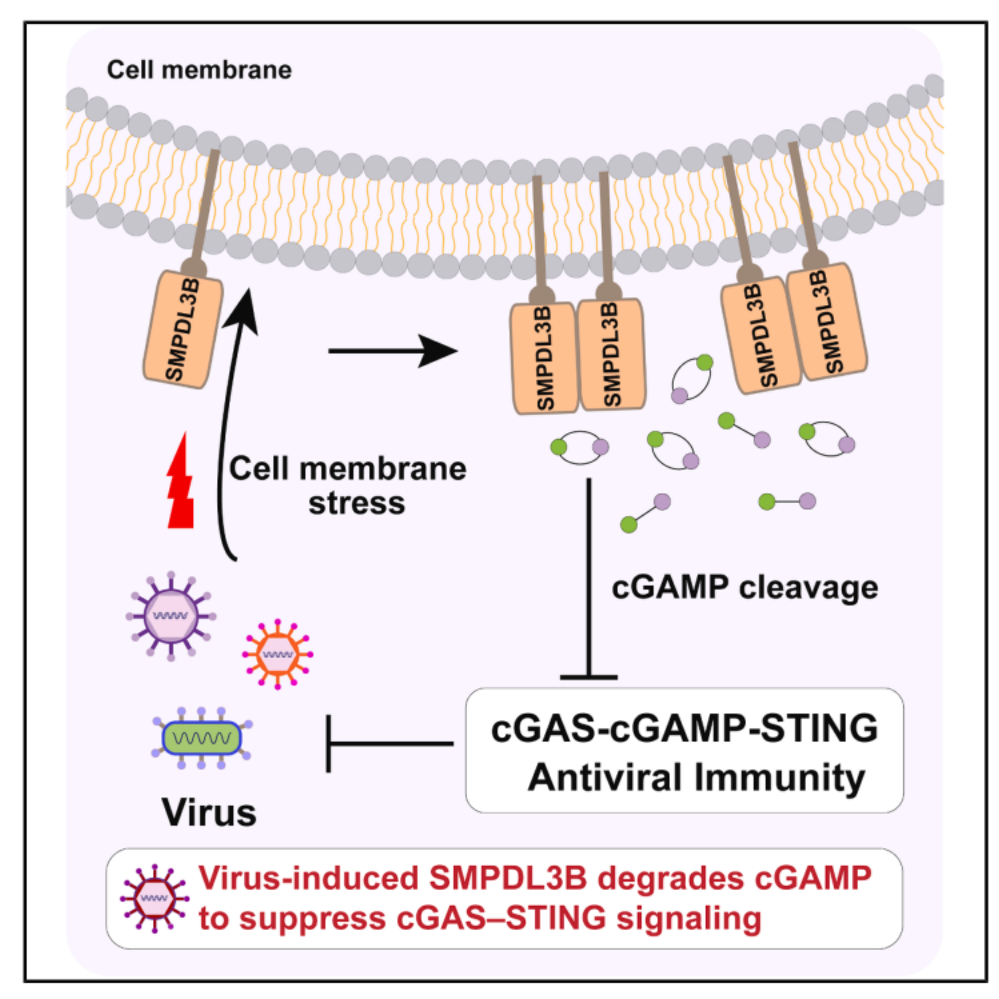
模型图:病毒侵染诱导的GPI蛋白SMPDL3B抑制cGAS-STING天然免疫
总之,本研究揭示了一条此前未被发现的调控通路:宿主酶SMPDL3B通过降解cGAMP,将普遍存在的膜应激与cGAS-STING天然免疫信号调控关联起来。该发现不仅拓展了我们对感染过程中天然免疫调控机制的认知,也为感染、炎症及自身免疫性疾病等相关领域的研究提供了新的视角。这是研究团队继发现LXR脂代谢诱导的SMPDL3A(SMPDL3B的同源家族成员)负调控cGAS-STING信号之后的又一系统性成果【5】。值得注意的是,SMPDL3A与SMPDL3B这两种蛋白酶分别在不同刺激条件下被激活:SMPDL3A响应LXR脂代谢信号,而SMPDL3B则响应细胞膜完整性改变信号;这一现象体现了机体在动态过程中实现稳态和系统性调控的机制。这些工作(脂代谢-SMPDL3A-cGAMP轴;病毒-SMPDL3B-cGAMP轴)为系统理解天然免疫系统、代谢网络及病原体互作的调控机理提供了新的理论框架。
清华大学药学院张从刚研究员为该论文通讯作者,张从刚课题组博士后王志萌、博士生侯燕飞为该论文第一作者,天津大学的刘培源老师,清华大学X射线晶体学平台的范仕龙老师,山西医科大学的彭泽旭老师以及首都医科大学佑安医院的粟斌老师在该课题实施过程中提供了宝贵的技术帮助和支持。该研究得到了北京市自然科学基金、国家自然科学基金项目、中国博士后科学基金、清华-北大生命科学联合中心、膜生物学国家重点实验室、山西医科大学-清华大学前沿医学协同创新中心、清华大学自主科研笃实专项的资助。
1. Jones JD, Dangl JL. The plant immune system. Nature. 2006;444(7117):323-9.
2. Zhang Z, Zhang C. Regulation of cGAS-STING signalling and its diversity of cellular outcomes. Nat Rev Immunol. 2025;25(6):425-444.
3. Eaglesham JB, et al. Viral and metazoan poxins are cGAMP-specific nucleases that restrict cGAS-STING signalling. Nature;566(7743):259-263.
4. Mardjuki R, et al. Identification of the extracellular membrane protein ENPP3 as a major cGAMP hydrolase and innate immune checkpoint. Cell Rep. 2024;43(5):114209.
5. Hou Y, et al. SMPDL3A is a cGAMP-degrading enzyme induced by LXR-mediated lipid metabolism to restrict cGAS-STING DNA sensing. Immunity. 2023;56(11):2492-2507.
阅读原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00461-3


