铁是维持脑发育和神经功能不可或缺的微量元素,其稳态平衡精细而脆弱——既驱动神经发生、突触形成和髓鞘化等关键过程,又在过量时如“双刃剑”般催生活性氧(ROS)积累,诱发氧化应激,损害神经干细胞更新与突触可塑性,最终危及认知记忆功能。SLC22A17是维持脑内铁稳态的关键转运蛋白,直接参与铁的跨膜转运与氧化应激反应的调控。它最初被鉴定为脂质运载蛋白lipocalin-2(LCN2)的受体,能够识别并结合不同铁负载状态的LCN2,从而精确调节细胞内外的铁流动。然而,尽管SLC22A17在中枢神经系统中广泛表达,科学界对于SLC22A17在脑内发挥的生理功能,以及维持铁稳态的具体机制尚不清楚。
2025年12月15日,清华大学药学院陈立功团队在Nature Communications《自然通讯》杂志发表了题为“Slc22a17 governs postnatal neurogenesis by maintaining the iron homeostasis in hippocampus”(Slc22a17 基因通过维持海马区铁稳态调控出生后神经发生)的最新研究成果。本研究首次揭示了SLC22A17通过调控海马神经干细胞内的铁稳态在脑发育期及成年神经发生中发挥关键作用,提出了其与自噬接头蛋白SQSTM1/p62互作,调节Nrf2/HO-1信号通路、维持氧化还原平衡的分子机制,为理解铁代谢失衡导致的神经发育障碍及相关神经退行性疾病的防治提供了新的理论依据与潜在治疗靶点。
在该研究中,转录组结果显示Slc22a17是海马中表达最丰富的铁转运蛋白之一。作者发现在胚胎第14天至出生后第14天这一关键发育窗口期,神经前体细胞内铁含量呈现先升后降的动态变化,与Slc22a17的表达水平呈负相关,提示Slc22a17在早期神经发生过程中调控神经干细胞铁稳态的可能性。为了探索Slc22a17在中枢神经系统中的功能,作者构建了Nestin-Cre介导的Slc22a17条件性敲除小鼠,系统地探究其在神经发育中的作用与机制。研究发现,Slc22a17缺失导致小鼠严重的生长发育迟缓和高死亡率,并显著损伤海马神经干细胞的增殖与分化能力。进一步研究发现,Slc22a17不仅对发育期神经发生至关重要,也在成年神经发生中发挥核心作用,Nestin-CreERT2介导的成年诱导型敲除小鼠在学习与空间记忆行为学中表现出明显缺陷。
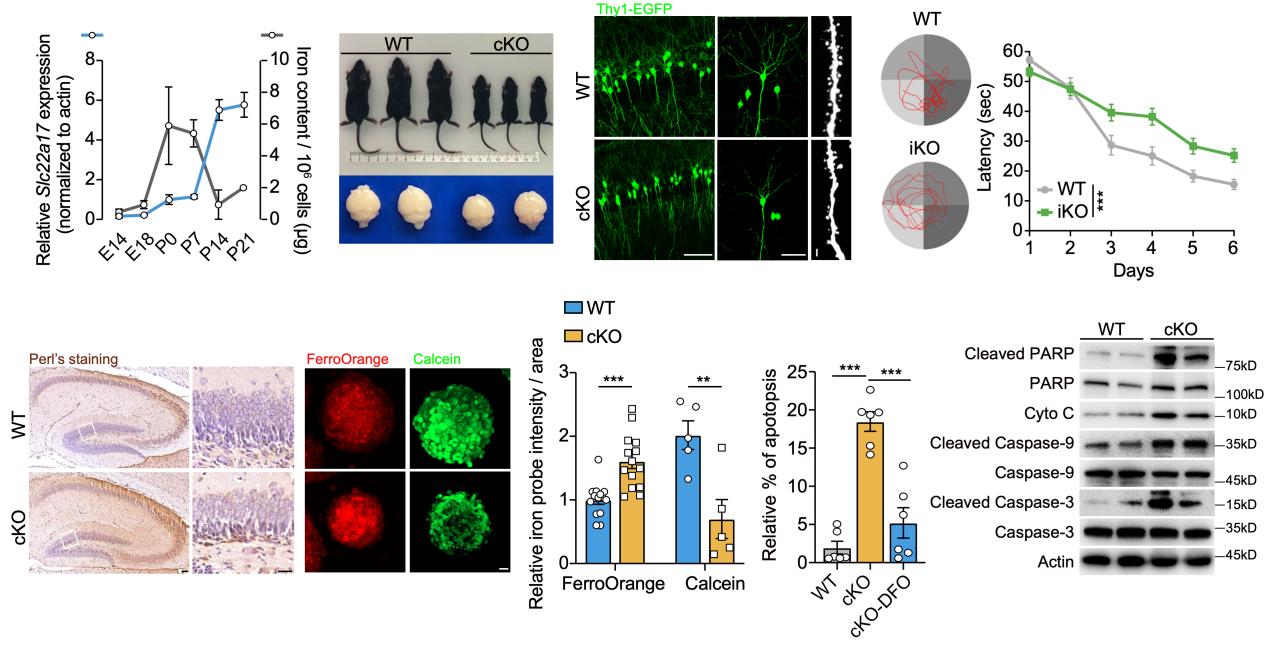
图1 Slc22a17缺失导致神经干细胞内铁累积,严重抑制神经发生并引起早期死亡
为了解析Slc22a17缺失导致神经发生受损的分子机制,作者采用电感耦合等离子体质谱(ICP-MS)、普鲁士蓝染色(Perl’s staining)以及铁荧光探针检测等多种手段,系统分析了不同组织及神经干细胞中的金属离子分布和铁转运状态。结果表明,Slc22a17缺失导致海马及神经干细胞内的铁显著累积,铁蛋白水平升高,铁流出途径受阻;这一铁稳态紊乱进一步诱发活性氧(ROS)过量、线粒体损伤及细胞凋亡。
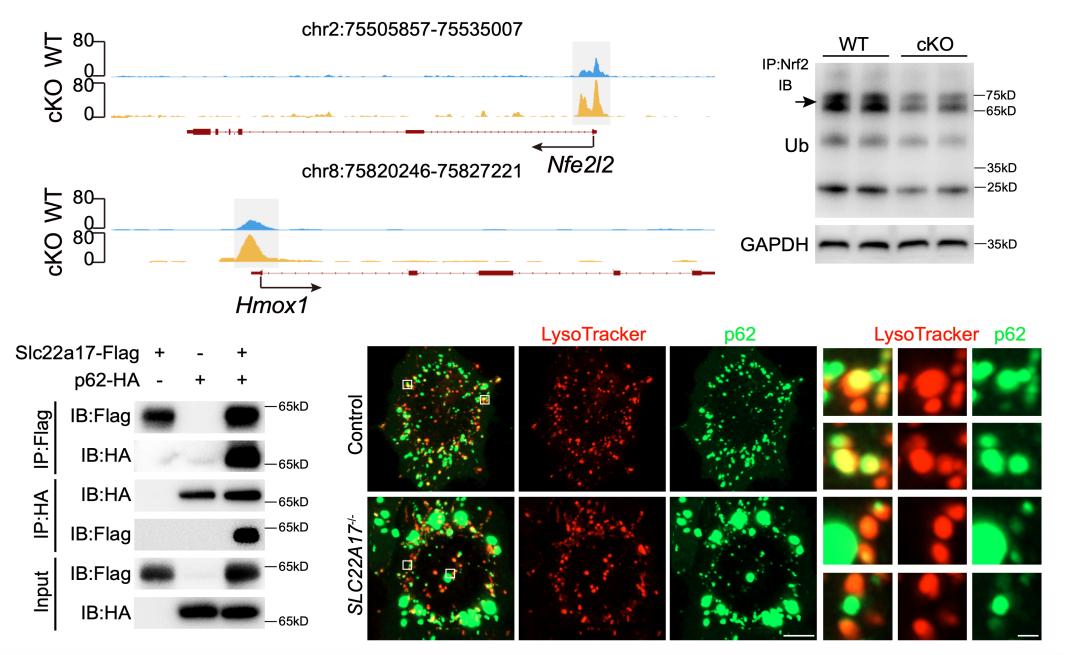
图2 Slc22a17缺失激活Nrf2/HO-1信号通路
另一方面,RNA-seq和ATAC-seq的多组学分析结果显示,Slc22a17缺失显著激活调控氧化应激反应的核心信号通路——Nrf2/HO-1通路。机制研究进一步表明,Slc22a17能够与自噬衔接蛋白p62相互作用,其缺失导致p62在细胞内累积,进而结合Keap1,解除对Nrf2的抑制,使Nrf2转入细胞核并启动Hmox1基因转录。功能验证实验显示,通过Nrf2基因敲除或使用HO-1竞争性抑制剂,可以有效缓解Slc22a17缺失所引起的神经干细胞增殖与分化障碍,以及成年小鼠的海马依赖性空间记忆缺陷。
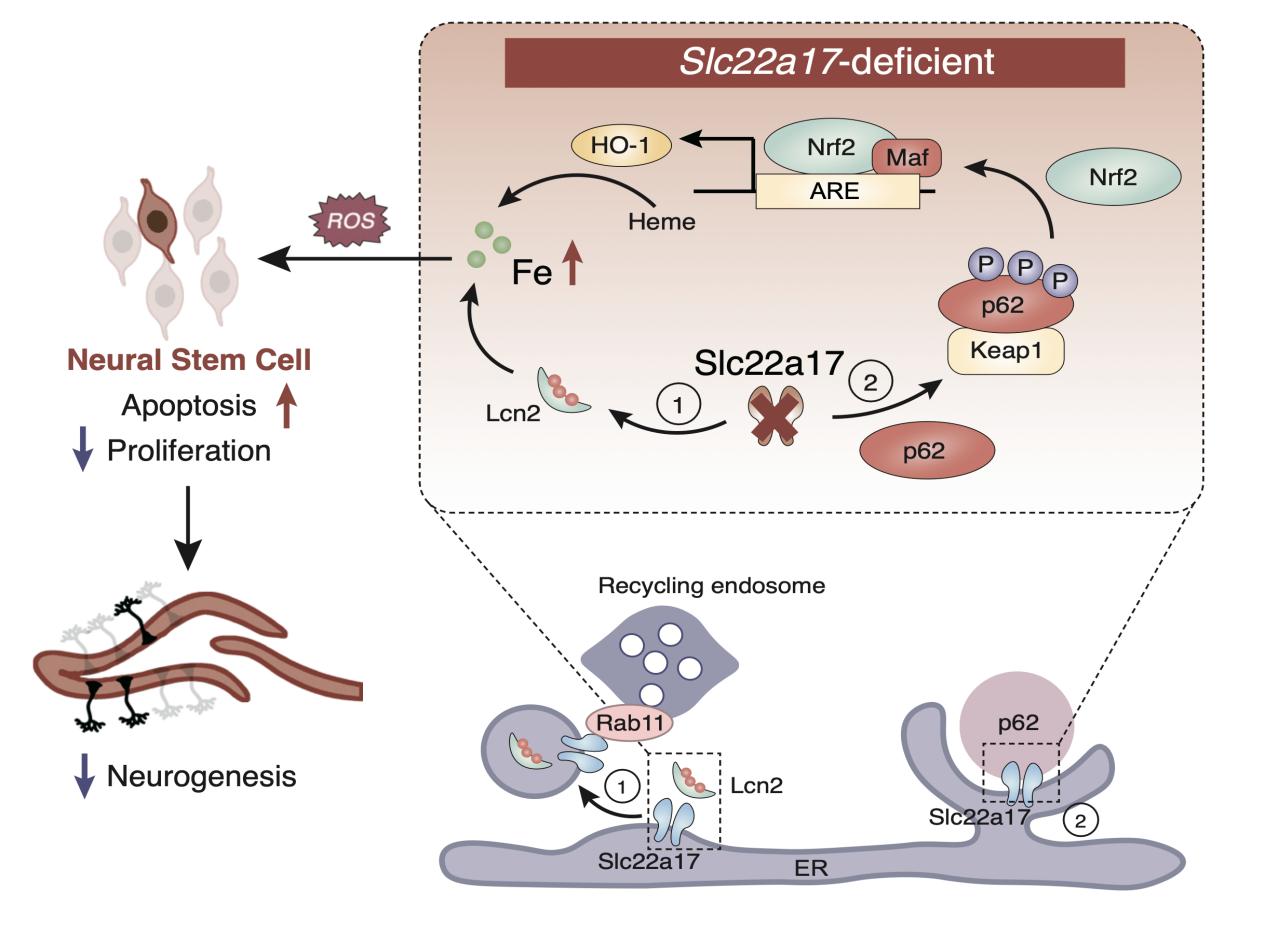
图3 Slc22a17调控铁代谢和神经发生的机制图
综上所述,Slc22a17缺失导致神经干细胞内铁异常积累,活性氧过量,引发细胞凋亡,从而严重抑制神经发生并引起早期死亡。机制上,Slc22a17通过与p62相互作用调控Nrf2/HO-1信号通路,其缺失进一步加剧铁相关氧化应激。此外该研究还发现,Slc22a17主要定位于内质网,可能作为上游铁调控枢纽,通过回收内体途径促进铁的外排。本研究揭示了Slc22a17作为海马铁传感器和转运关键分子的独特作用,阐明了铁稳态、氧化应激与神经发生之间的紧密联系,为铁代谢相关神经发育障碍及认知记忆功能障碍的治疗提供了新的潜在靶点和治疗方向。
清华大学药学院陈立功教授为本文通讯作者,清华大学药学院已毕业博士陶蕾、药学院博士生滕龙、已毕业博士葛梦梦以及博士生王亚棋为该论文共同第一作者。军事医学研究院脑科学中心袁增强教授,清华大学生命学院米达副教授,基础医学院贾怡昌教授,药学院秦为课题组为本项目的顺利开展提供了重要建议和技术支持。该研究得到了国家自然科学基金委重点项目、科技部国家重点研发计划,膜生物学全国重点实验室等项目资助。
原文链接:https://www.nature.com/articles/s41467-025-66108-w


