CD4+ T细胞是适应性免疫系统核心调控细胞,广泛参与机体抗感染、抗肿瘤及免疫稳态维持等多种生理病理过程,其功能异常与自身免疫病、感染性疾病、肿瘤等多种疾病的发生发展密切相关。SLC转运蛋白家族成员众多,通过介导营养物质转运、离子平衡调控及代谢产物交换等关键过程,充当CD4+ T细胞代谢与功能调控的“核心门控”角色。大量研究证实,SLC转运蛋白在CD4+ T细胞中的表达异常或功能紊乱,会直接影响CD4+ T细胞的活化、亚群分化及效应功能发挥,进而参与多种免疫相关疾病的病理进程,提示靶向CD4+ T细胞中特定SLC转运蛋白,有望成为免疫相关疾病治疗的新策略与潜在靶点。
2025年12月19日,清华大学药学院陈立功课题组及其合作者以“VNUT介导的ATP释放通过P2X7R-JNK-FOXO3a-Eomes信号级联抑制辅助性T细胞(Th)1型分化”(VNUT-mediated ATP release suppresses T helper (Th) 1 cell differentiation via the P2X7R-JNK-FOXO3a-Eomes signaling cascade)为题在《科学进展》(Science Advances)杂志在线发表研究论文,该研究报道了ATP转运蛋白VNUT通过调控P2X7R-JNK-FOXO3a-Eomes信号通路对Th1细胞的分化产生了调控作用。
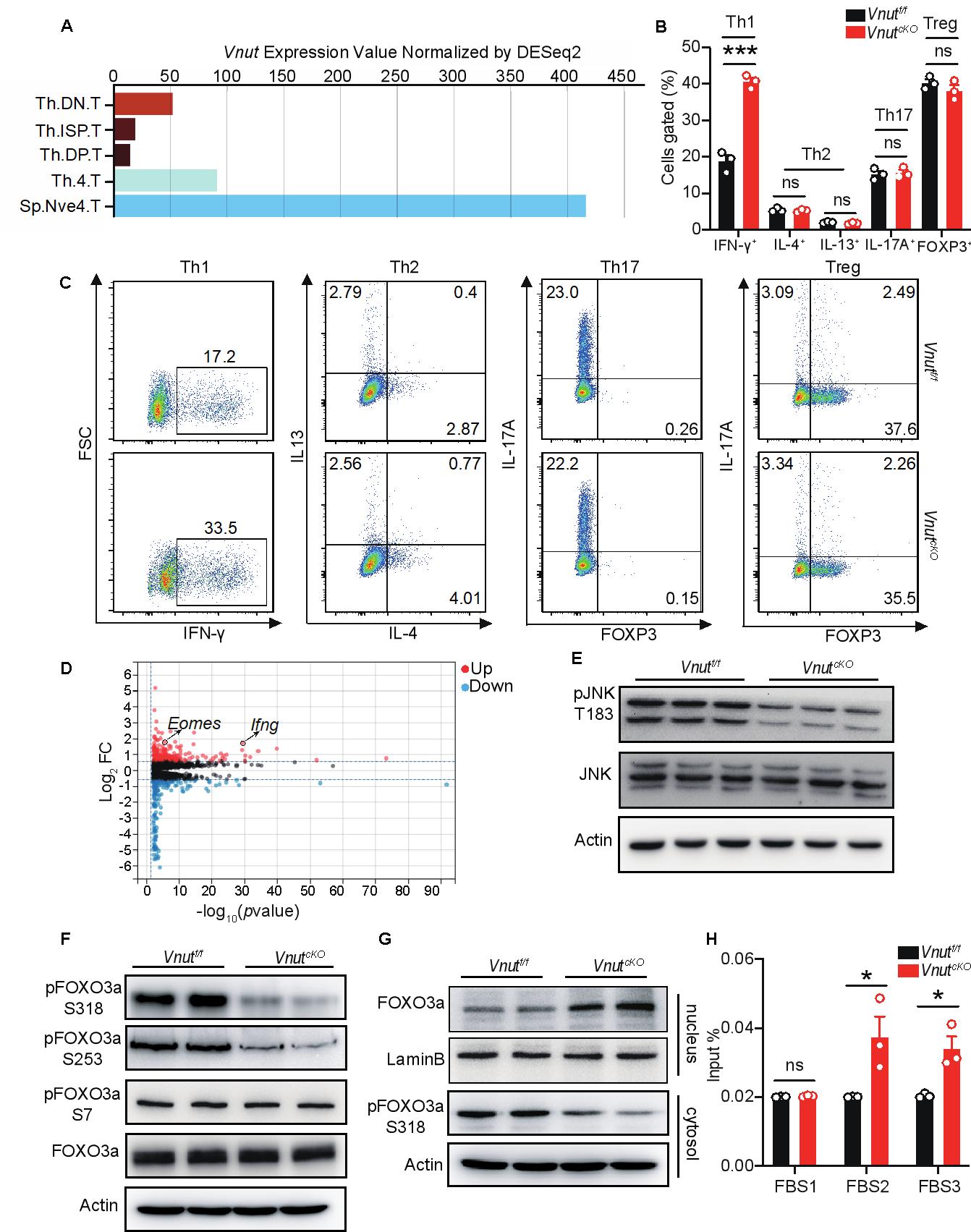
图1 VNUT通过P2X7R-JNK-FOXO3a-Eomes对Th1分化进行调控
本研究首先发现VNUT在CD4+ T细胞发育成熟后,其表达量呈显著上调趋势(图 1A)。为探究VNUT在CD4+ T细胞分化中的功能,利用loxp-cre条件性敲除技术,构建了CD4+ T细胞特异性Vnut基因敲除(cKO)小鼠模型。体外诱导分化实验结果显示,与野生型相比,cKO小鼠来源的CD4+ T细胞向Th1亚型的分化能力显著增强,具体表现为Th1细胞比例升高及特征细胞因子IFN-g表达上调(图 1B、C)。为解析上述表型的分子机制,对cKO小鼠来源的Th1细胞进行RNA-seq分析,发现转录因子Eomes的mRNA水平均显著升高(图 1D)。进一步的机制探究表明,VNUT通过调控CD4+ T细胞受体(TCR)刺激后的ATP释放,进而影响ATP受体P2X7R的活化状态;而P2X7R的活化差异会进一步传导至下游信号通路,调控JNK激酶的磷酸化水平(图 1E)。后续实验证实,磷酸化的JNK可直接作用于转录因子FOXO3a,通过磷酸化修饰调控其核质穿梭及亚细胞定位(图 1F、G),进而影响FOXO3a对Eomes基因的转录调控活性(图 1H)。最终,通过这一“VNUT-ATP-P2X7R-JNK-FOXO3a-Eomes”的级联调控通路,VNUT实现了对CD4+ T 细胞向Th1亚型分化过程的调控。
进一步功能验证实验表明,Vnut基因敲除可通过增强Th1细胞的效应功能,调控宿主的抗感染与抗肿瘤应答:一方面能显著提升小鼠对单核增生性李斯特菌感染的清除能力,增强机体抗感染免疫力(图2A-C);另一方面可有效抑制肿瘤组织的生长增殖,展现出明确的抗肿瘤活性(图2D-G)。此外,VNUT特异性抑制剂的干预实验显示,其同样能发挥一定的肿瘤生长抑制作用(图2H-J)。结合前文分子机制研究结果,上述数据共同证实,VNUT通过调控Th1细胞分化及功能,参与调控宿主抗感染和抗肿瘤免疫应答,提示VNUT有望成为抗感染与抗肿瘤治疗的潜在药物靶点。
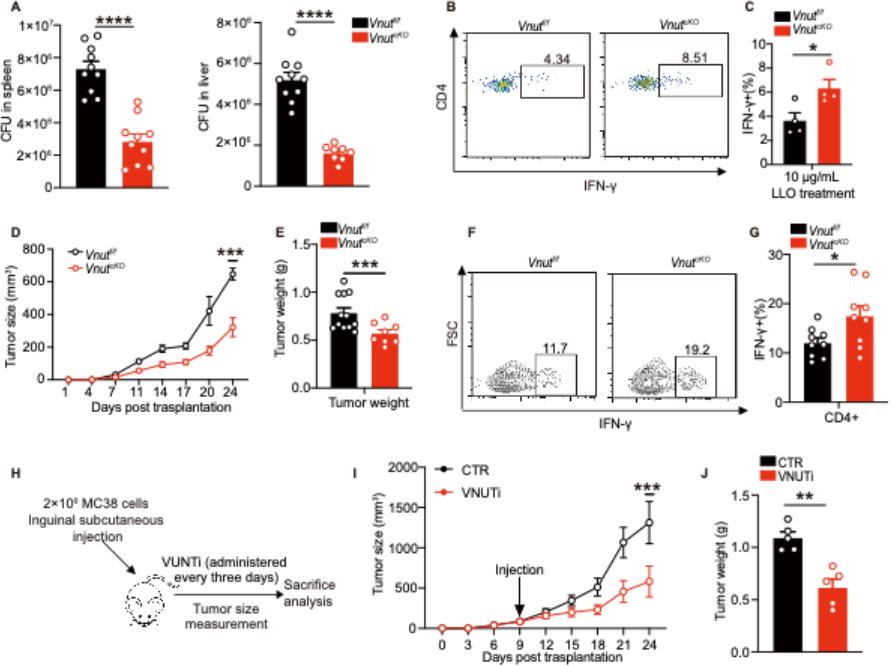
图2 Vnut敲除增强抗细菌和抗肿瘤免疫
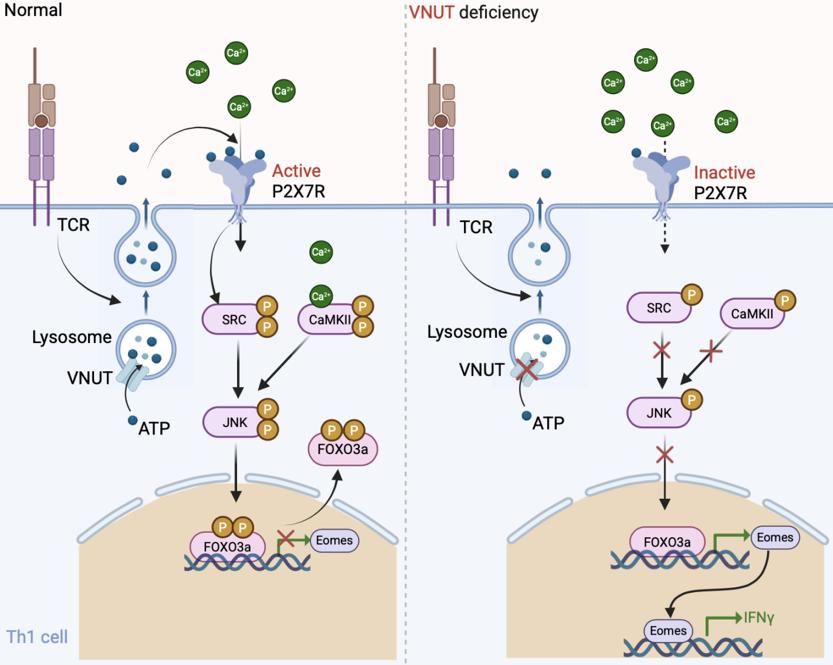
图3 VNUT对Th1调控机制示意图
清华大学药学院陈立功教授和免疫所王小虎研究员为本文共同通讯作者,清华大学药学院已毕业博士生武博隆为本文第一作者,清华大学药学院博士生盛琳琳和硕士生冯子怡(苏大联培)为本文合作作者。该研究得到国家自然科学基金、科技部国家重点研发计划等项目资助.。
原文链接:https://www.science.org/doi/epdf/10.1126/sciadv.adz7600


