2026年2月4日,清华大学药学院尹航教授课题组在《Cell Chemical Biology》在线发表了题为“Aerobic glycolysis promotes NLRP3 inflammasome activation via NLRP3 lactylation”的研究论文。该研究发现了代谢物乳酸能够直接乳酸化修饰NLRP3,从而调控NLRP3炎症小体激活的新机制,为免疫系统中小分子代谢产物的免疫调节功能提供了新的见解。

天然免疫在抵御外来病原体感染时发挥着重要作用。细胞焦亡是细胞受到外来病原体感染时发生的一种程序性炎性死亡,对于机体抵抗病原体感染和维持稳态十分重要。迄今为止,已经有多种模式识别受体被证明能够响应多种刺激形成炎症小体介导细胞焦亡,其中NLRP3是NLR家族蛋白中重要的组成成员之一。NLRP3的激活需要两个步骤:启动步骤和激活步骤。首先,NLRP3可以被核转录因子(Nuclear factor kappa B,NF-κB)或其他转录因子激活后诱导表达。第二步是激活阶段,NLRP3可以被多种刺激物所激活,包括细菌毒素如尼日利亚菌素、细胞外ATP、MSU、胆固醇结晶和淀粉样蛋白等颗粒物。一旦激活后,NLRP3招募下游蛋白组装成炎症小体复合体,引发细胞焦亡和下游炎症反应。但是过度的细胞焦亡也会出现炎症表型,包括临床上败血症后期出现的炎症因子风暴等,因此细胞焦亡的调控也是重要的科学问题。近年来,越来越多的研究发现免疫细胞发挥功能的同时伴随着代谢改变,代谢小分子也被报道参与到免疫调节的过程中,免疫与代谢的密切联系越来越是值得关注的问题。
研究团队通过研究巨噬细胞焦亡的代谢特征定位到差异代谢物乳酸,系统性研究了乳酸对巨噬细胞焦亡的调控和分子作用机制。作者分别通过化学干预和基因敲降的方式对细胞内乳酸生成进行调控,发现乳酸调控NLRP3炎症小体激活介导的细胞焦亡而不影响AIM2炎症小体的激活。在机制研究上,作者定位到乳酸会促进NLRP3招募下游接头蛋白ASC和激活,通过免疫印迹分析发现NLRP3蛋白存在乳酸化修饰,并且NLRP3与乳酰转移酶AARS2存在相互作用。作者进一步通过质谱鉴定到了NLRP3的乳酸化位点并对这些位点进行突变验证以及在巨噬细胞中进行了功能学验证,发现在Nlrp3-/-的iBMDMs细胞中稳转了K24R和K565R双突变NLRP3后能显著抑制NLRP3激活介导的细胞焦亡,并且能明显减弱NLRP3的乳酸化程度。随后在小鼠多菌群感染的疾病模型中,研究团队也证明了乳酸对疾病的影响。
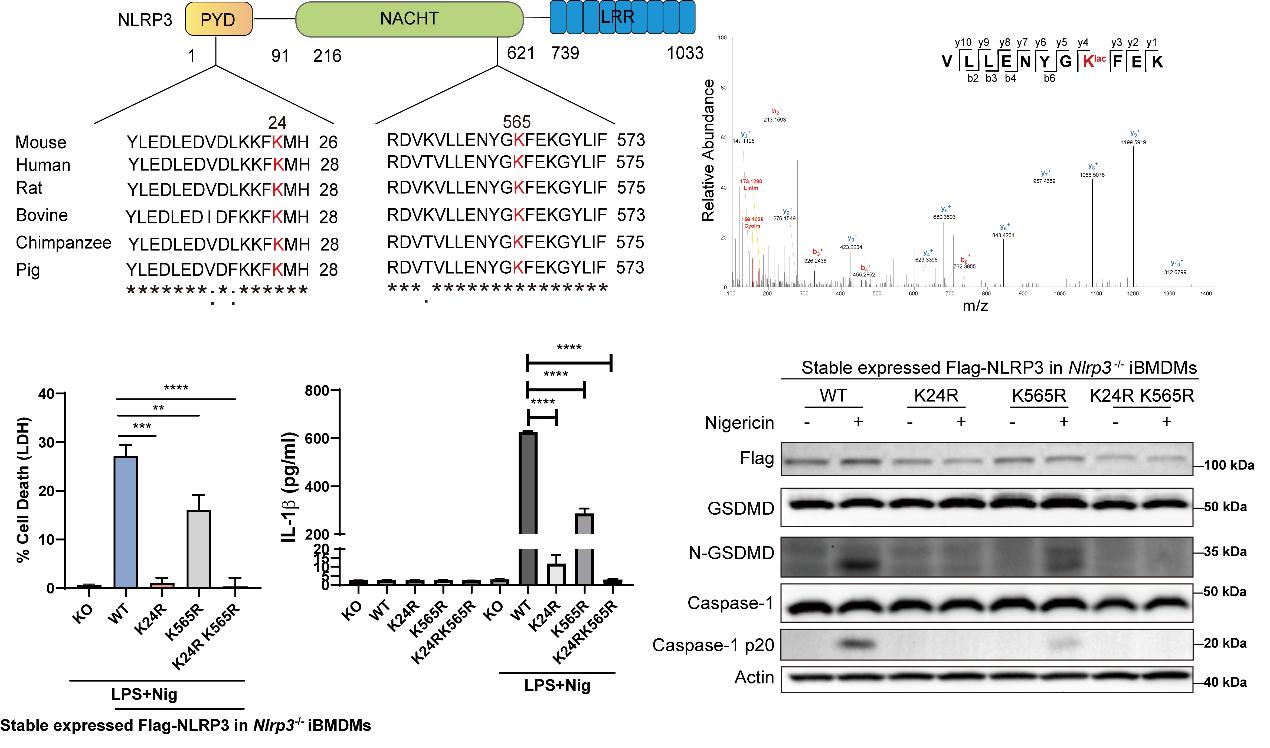
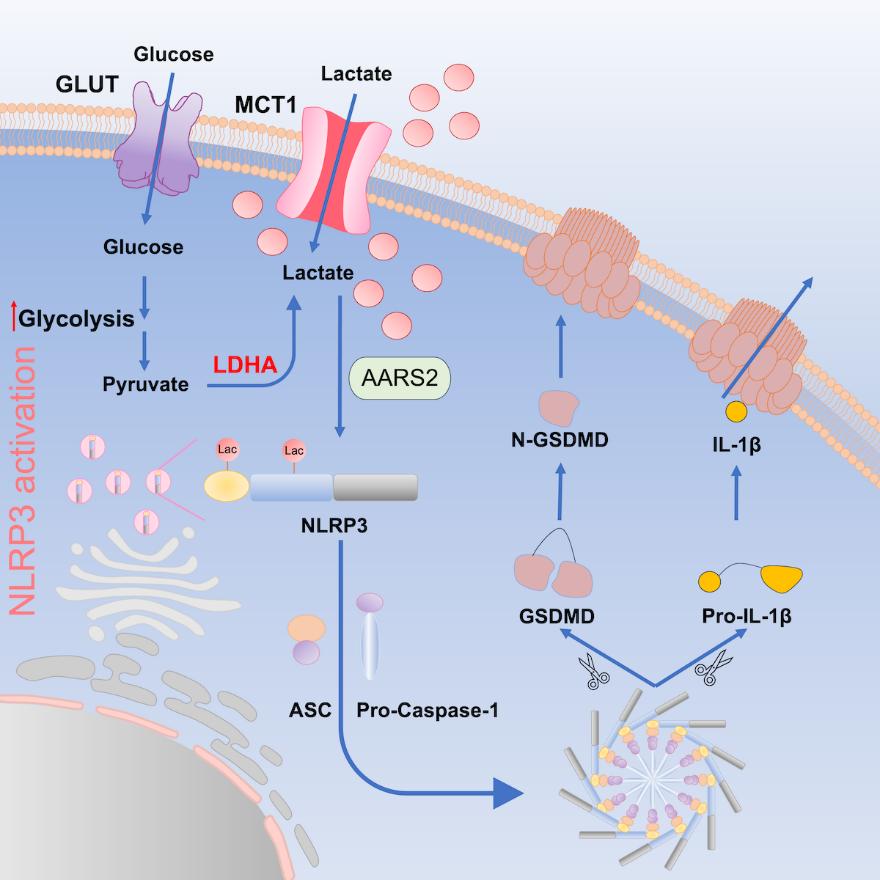
综上,本研究发现糖酵解通路代谢产物乳酸的能够通过乳酸化修饰NLRP3,调控NLRP3炎症小体的激活以及下游的炎症反应,为免疫系统中小分子代谢产物的免疫调节功能提供了新的见解,为焦亡相关疾病的药物开发提供新思路和新靶标。
清华大学药学院尹航教授为本文通讯作者,清华大学药学院已毕业博士刘薇为该论文第一作者。清华大学药学院在读博士生张天一和清华大学药学院胡泽平课题组王博弘博士为本项目的顺利开展提供了重要的技术支持。本研究获得了国家自然科学基金、国家科技重大专项等项目的资助。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S2451945626000231?dgcid=author&sessionid=


