清华大学尹航教授和张莹助理研究员的科研团队近期在《Advanced Science》上发表研究,首次揭示了Nucleophosmin 1(NPM1)通过识别特定RNA基序并诱导相分离,进而介导mRNA被选择性分选进入EVs的分子机制。研究还发现,在非小细胞肺癌(NSCLC)患者血清来源的EVs中,NPM1蛋白与EGFR mRNA水平显著升高,提示该机制在肺癌进展中可能发挥重要作用。
细胞外囊泡(EVs)是细胞间通讯的重要媒介,能够携带蛋白质、脂质与核酸等生物活性分子,影响免疫应答、发育调控及疾病进程等多种生理病理过程。尽管已有研究表明EVs可递送功能性mRNA至受体细胞,但mRNA是如何被选择性装载入EVs的具体机制尚不清楚。解析这一机制对于理解EVs的生物学功能及其在疾病治疗中的应用具有重要意义。
图1:NPM1被鉴定为EV中mRNA结合蛋白
研究通过寡聚dT捕获技术与蛋白质组学分析,从HeLa细胞来源的EVs中鉴定出100多个与poly(A) RNA结合的蛋白质。进一步筛选发现其中NPM1的敲低显著降低EVs中mRNA水平,提示NPM1可能参与mRNA向EVs的装载过程。
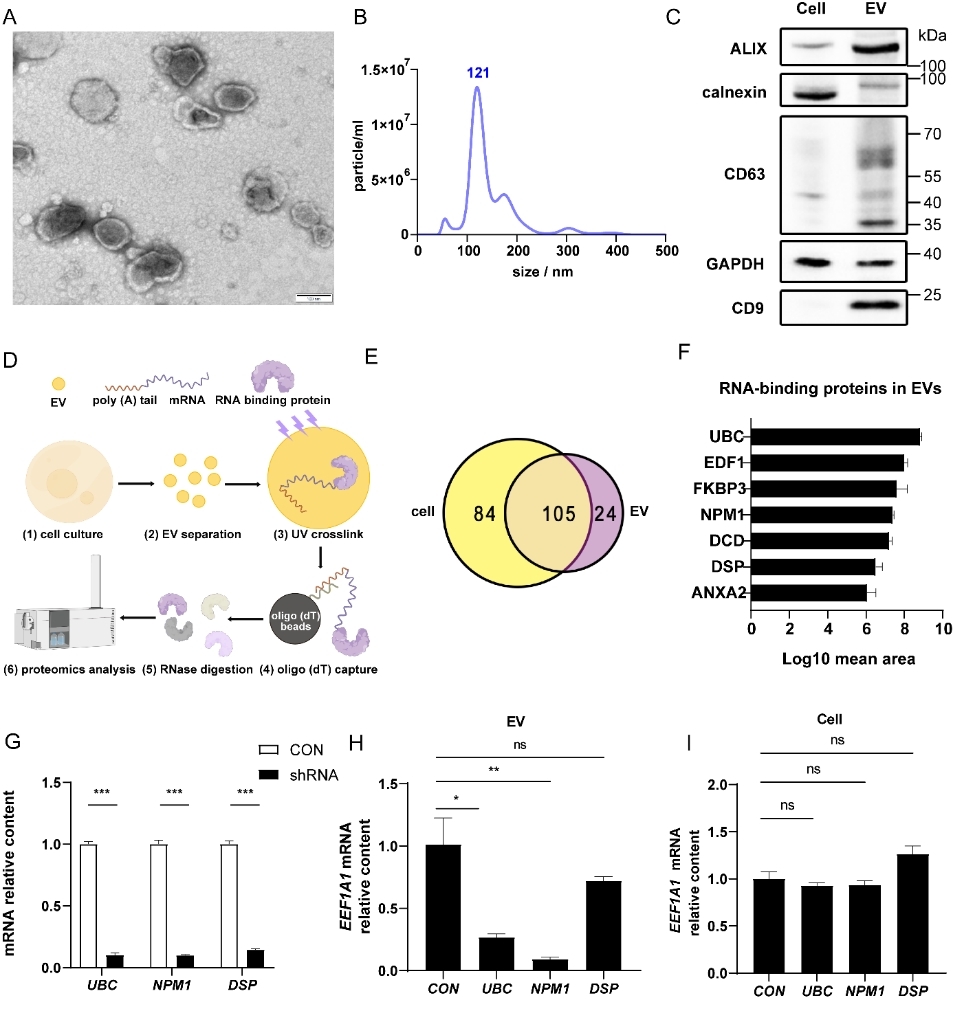
图2:NPM1选择性分选mRNA进入EVs
通过CRISPR-Cas9构建NPM1敲除细胞系,RNA-seq分析显示NPM1缺失导致EVs中多个癌症相关mRNA(如EGFR、IGF2R、TLK2)水平下降。RNA免疫共沉淀实验证实NPM1与这些mRNA直接结合。RT-qPCR与流式细胞分析技术证实NPM1可携带这些mRNA进入到受体细胞中。
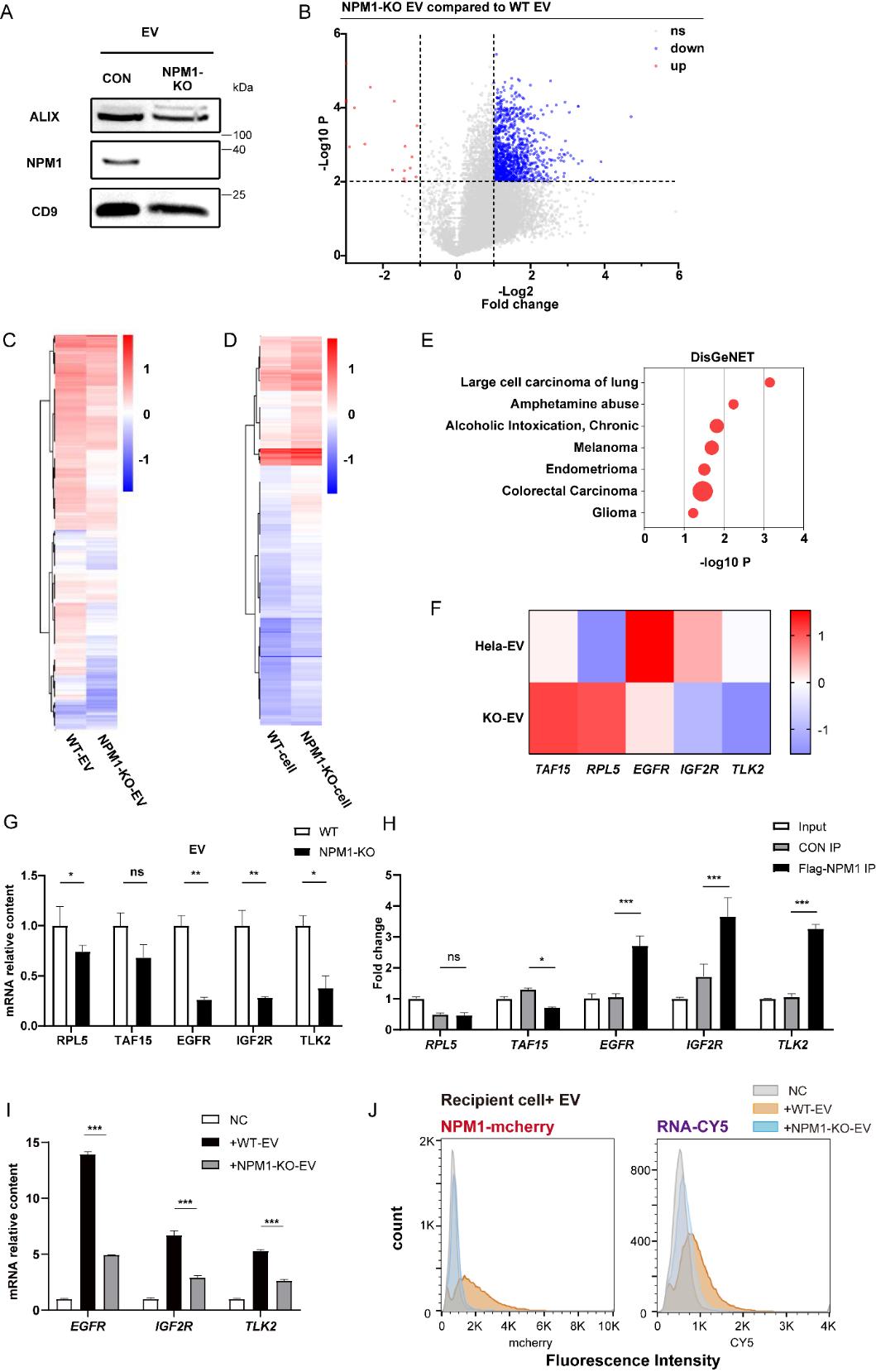
图3:NSCLC患者血清EVs中NPM1与EGFR mRNA水平正相关
在18例NSCLC患者与18例健康对照的血清EVs中,NPM1蛋白与EGFR mRNA水平均显著升高,且两者呈正相关,提示该机制在肺癌中具有潜在临床意义。
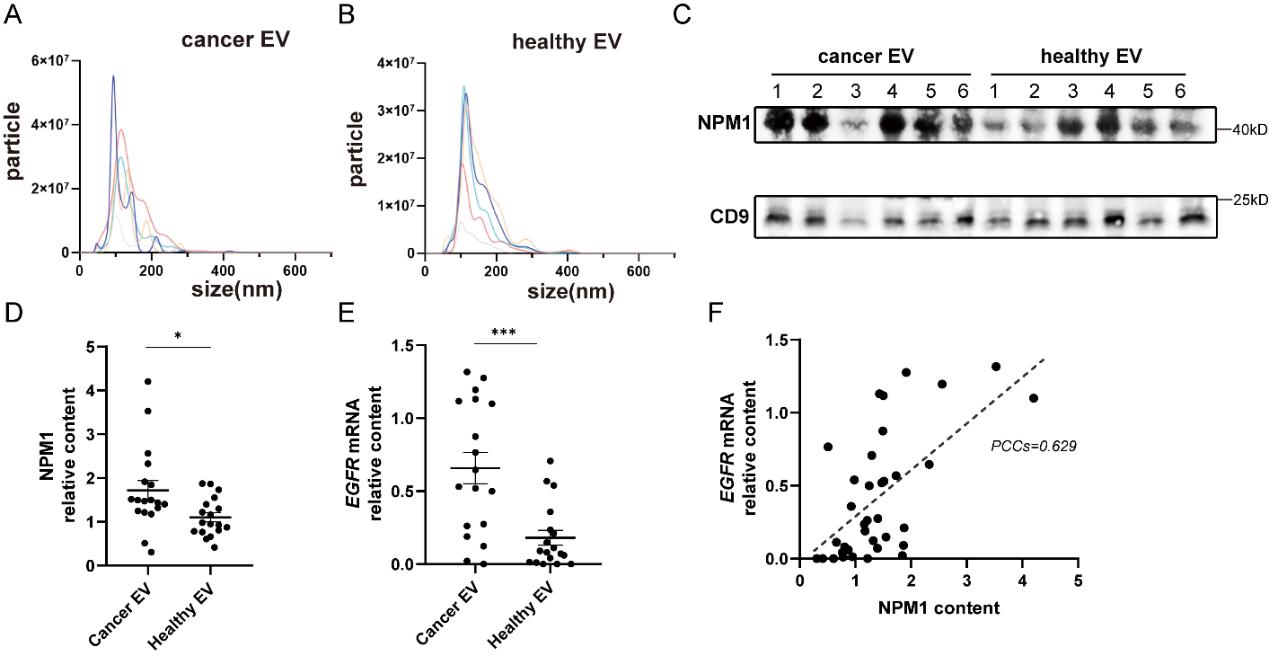
图4:鉴定NPM1结合的RNA基序及其功能验证
通过生物信息学分析鉴定出一个8核苷酸基序“CUGGGAUU”,该基序在EGFR等癌症相关mRNA中存在。通过RNA-pulldown技术验证NPM1与该基序的特异性结合能力。利用Cre-LoxP报告系统验证,将该基序连接至Cre mRNA的3’端可显著增强其通过EVs递送至受体细胞的效率,且该过程对NPM1具有依赖性。
图5:NPM1与mRNA共定位于晚期内体与多囊泡体
蔗糖密度梯度离心与高分辨率显微成像显示,NPM1与RNA在细胞内共定位并主要富集于CD63标记的多囊泡体中,提示NPM1-mRNA复合物通过晚期内体-多囊泡体途径进入EVs。
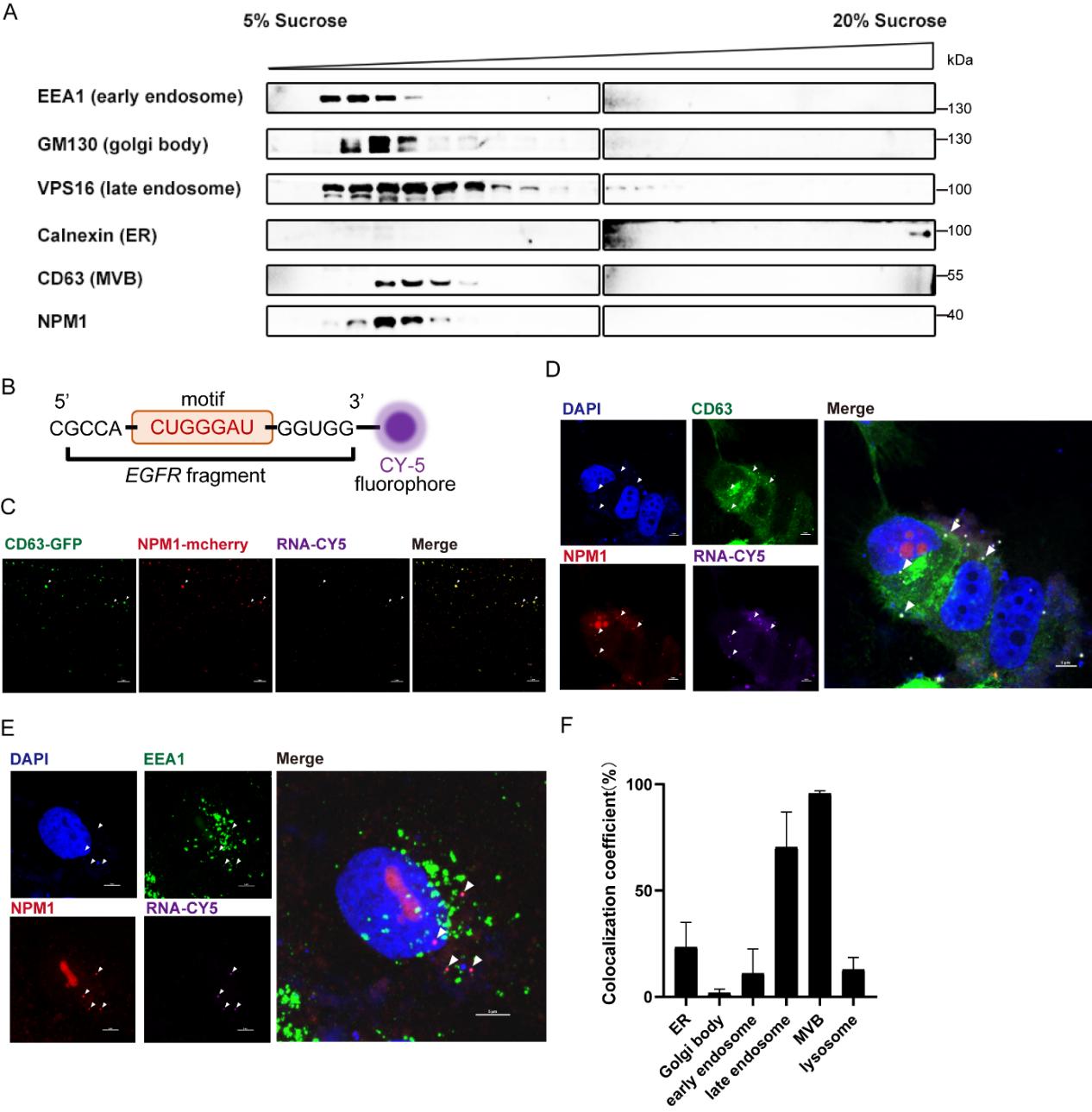
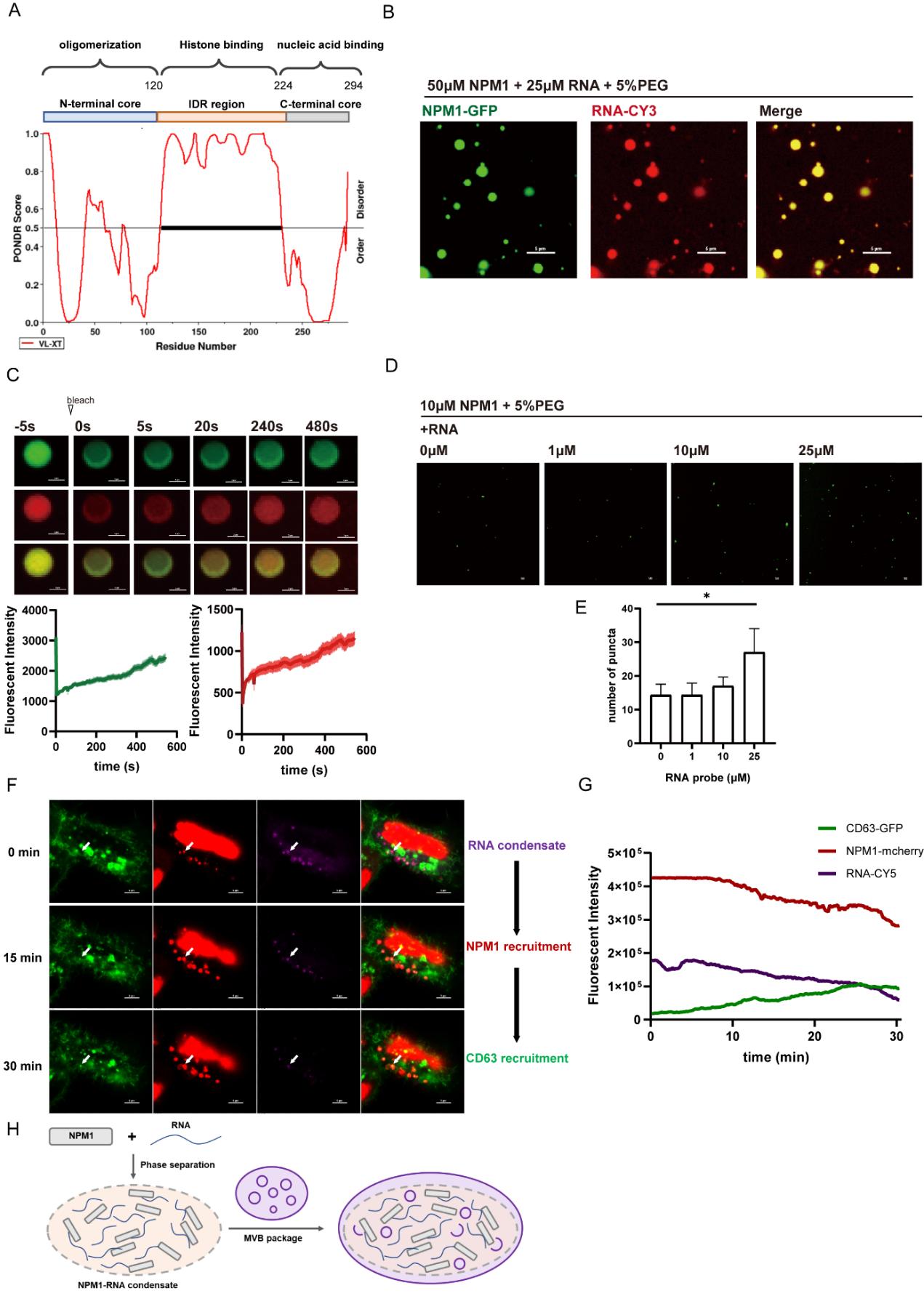
图6:NPM1与RNA形成相分离凝聚体并招募MVB膜
体外实验表明,NPM1可通过其固有无序区域与RNA形成动态液相凝聚体。RNA在凝聚体形成的过程中起促进功能。活细胞成像进一步显示,NPM1-RNA凝聚体可招募CD63标记的多囊泡体膜,促进其包装进入EVs。
NPM1的异常功能与多种恶性肿瘤的发病相关。本研究系统阐明了细胞质内NPM1通过识别RNA基序、形成相分离凝聚体并导向多囊泡体途径,从而介导mRNA选择性分选进入EVs的完整机制。该发现不仅深化了对EVs 内容物分选机制的理解,也为基于EVs的RNA递送与肿瘤治疗策略提供了新思路。
本文第一作者为清华大学药学院博士生张凯翔,合作者包括清华大学生命科学院鲁志副教授、北京大学第一医院胸外科与胃肠外科临床团队,研究获得国家重点研发计划、国家自然科学基金等资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.2024xxxxx


